肝動脈化学塞栓療法と薬剤2種の併用で肝細胞がんへの治療効果が向上 レンバチニブとペムブロリズマブ併用による肝細胞がんの完治に期待
近畿大学医学部(大阪府大阪狭山市)内科学教室(消化器内科部門)主任教授 工藤正俊らを中心とした国際共同研究グループは、切除不能な非転移性肝細胞がん患者に対して、従来の治療法である肝動脈化学塞栓療法(TACE)※1 に、分子標的薬であるレンバチニブ(商品名:レンビマ)と免疫チェックポイント阻害剤※2 であるペムブロリズマブ(商品名:キイトルーダ)の2種の薬剤を併用することで、TACEだけの治療と比較して無増悪生存期間※3 を有意に延長し、全生存期間※4 が延長する傾向を示すことを、多施設共同無作為化二重盲検第3相試験※5 で明らかにしました。本研究成果により、今後TACEとレンバチニブとペムブロリズマブを併用した手法が、切除不能な非転移性肝細胞がん患者の標準治療となり、完治も可能になると期待されます。
本件に関する論文が、令和7年(2025年)1月9日(木)に、世界五大医学雑誌の一つである国際的な学術誌"The Lancet(ザ ランセット)"にオンライン掲載されました。
【本件のポイント】
●切除不能な非転移性肝細胞がんの標準治療であるTACEに、レンバチニブとペムブロリズマブの2種の薬剤を併用することで、治療効果が高まることを世界で初めて証明
●この治療法はTACEのみの治療と比較して、患者の無増悪生存期間を延長し、全生存期間も改善する傾向がある
●本研究成果により、この画期的な治療法が承認されれば、切除不能な非転移性肝細胞がん患者を完治させることも可能になると期待
【本件の背景】
切除不能で、遠隔転移や脈管浸潤がない非転移性肝細胞がん患者に対する治療は、カテーテルで抗がん剤と塞栓物質を注入してがん細胞の増殖を抑えるTACEという手法が昭和58年(1983年)に日本で開発され、瞬く間に世界の標準治療となりました。一方、肝細胞がんの薬物療法は、平成21年(2009年)ソラフェニブ(商品名:ネクサバール)をはじめとして、平成30年(2018年)レンバチニブ、令和2年(2020年)アテゾリズマブ(商品名:テセントリク)+ベバシズマブ(商品名:アバスチン)、令和4年(2022年)デュルバルマブ(商品名:イミフィンジ)+トレメリムマブ(商品名:イジュド)などの有効な薬物が、次々に開発されています。TACEの効果には限界があるため、薬物療法を組み合わせたさまざまな治療が試されており、薬剤が開発される度に治療方針が大きく変わりつつあります。
これまで、非転移性肝細胞がん患者に対して薬物療法とTACEを組み合わせた臨床試験が6試験行われましたが、近畿大学医学部を中心とする研究グループが行った、医師主導試験であるTACTICS試験※6 以外は全て失敗となりました。その後、研究グループはレンバチニブとTACEを組み合わせる治療法(LEN-TACE療法)を開発し、良好な治療効果を示すことを確認しました。この療法は非常に効果が高いものの、令和2年(2020年)以降は肝細胞がんにおいても他のがんと同じく免疫チェックポイント阻害剤による治療が主流となり、第一選択の治療法となりつつあります。そこで、LEN-TACE療法に免疫チェックポイント阻害剤を組み合わせることで、どちらか一方よりもさらに効果の増強が期待できるのではないか、という仮説を立てましたが、効果と安全性については未知数で、大規模な臨床試験での検証が望まれてきました。
【本件の内容】
研究グループは、先行研究で開発したLEN-TACE療法に、免疫チェックポイント阻害剤であるペムブロリズマブを組み合わせ、切除不能な非転移性肝細胞がん患者に対する効果と安全性を検証するため、多施設共同無作為化二重盲検第3相試験を行いました。ペムブロリズマブは、米国では第1相試験※7 の結果により迅速に承認されている薬剤であり、レンバチニブ+ペムブロリズマブの併用療法は良好な効果が確認されています。また、臨床的には有意義な全生存期間の延長効果も認められている薬剤です。
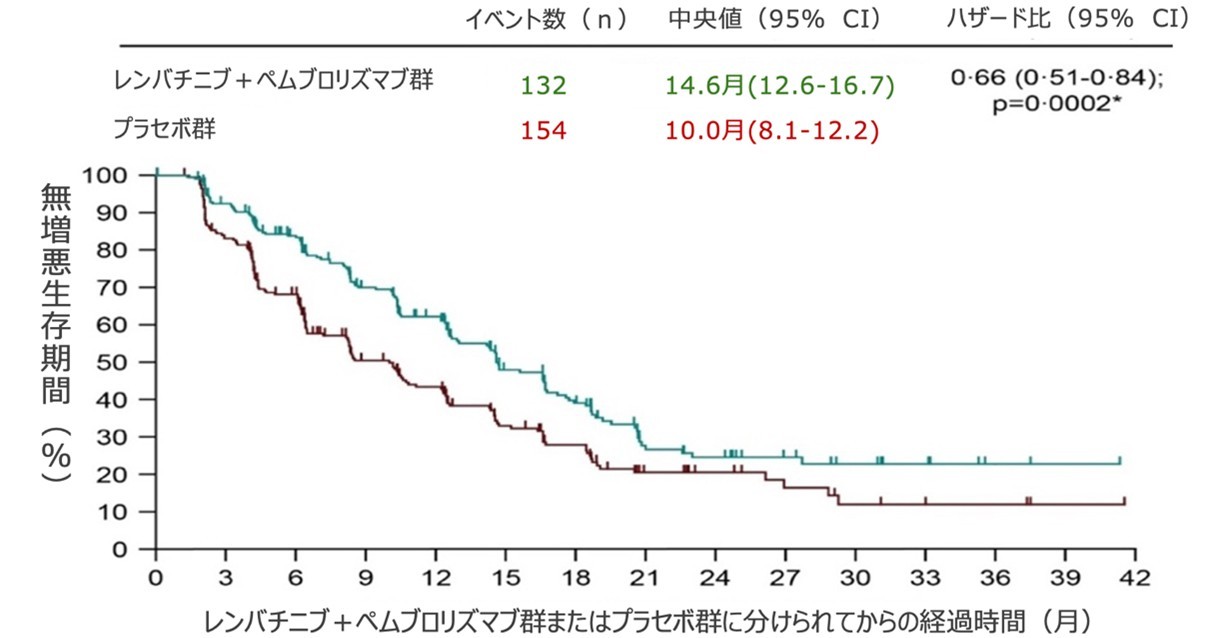
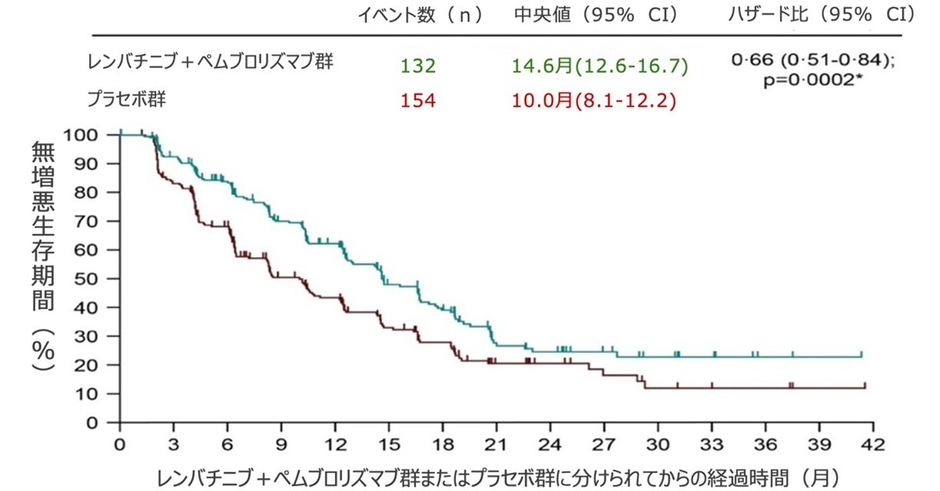
この試験では、33カ国・地域の137施設から、切除不能な非転移性肝細胞がんでTACEが適応となる患者のうち、身体的な状態として活動に制限がない・もしくは軽作業や座って行う作業が可能で、肝障害の程度が軽微な480人を対象としました。患者は、TACE+レンバチニブ+ペムブロリズマブ、またはTACE+プラセボ(偽薬)のいずれかを受ける群に、1:1で無作為に割り付けました。治療後の無増悪生存期間および全生存期間を調査した結果、無増悪生存期間の中央値は、プラセボ群で10.0カ月であるのに対し、レンバチニブ+ペムブロリズマブ群では14.6カ月となり、無増悪生存期間が延長しました。また、レンバチニブ+ペムブロリズマブ群237例中69例(29%)、プラセボ群243例中82例(34%)が死亡し、24.0カ月全生存率はレンバチニブ+ペムブロリズマブ群で75%、プラセボ群で69%でした。
結論としてTACE+レンバチニブ+ペムブロリズマブによる治療は、TACE+プラセボと比較して、切除不能な非転移性肝細胞がん患者の無増悪生存期間を有意に、かつ臨床的に意義のある延長効果を示し全生存期間も改善する傾向を示しました。本研究成果により、TACE+レンバチニブ+ペムブロリズマブによる治療は、切除不能な非転移性肝細胞がん患者の標準治療になり、完治させることも可能になると期待されます。
【論文概要】
掲載誌:The Lancet(インパクトファクター:98.4@2023)
論文名:Transarterial chemoembolisation combined with lenvatinib plus pembrolizumab versus dual placebo for unresectable, non-metastatic hepatocellular carcinoma (LEAP-012): a multicentre, randomised, double-blind, phase 3 study
(切除不能な非転移性肝細胞がんに対する肝動脈化学塞栓療法とレンバチニブ+ペムブロリズマブの併用療法とプラセボの併用療法との比較(LEAP-012):多施設共同無作為化二重盲検第3相試験)
著者:工藤正俊1, Zhenggang Ren2, Yabing Guo3, Guohong Han4, Hailan Lin5, Jinfang Zheng6, 小笠原定久7, Ji Hoon Kim8, Haitao Zhao9, Chuan Li10, David C Madoff11, R Mark Ghobrial12, 河岡友和13, Rene Gerolami14, 池田公史15, 熊田博光16, Anthony B El-Khoueiry17, Arndt Vogel18, Xiang Peng19, Kalgi Mody20, Corina Dutcus20, Leonid Dubrovsky19, Abby B Siegel19, Richard S Finn21, Josep M Llovet22
所属:1 近畿大学医学部内科学教室(消化器内科部門)、2 復旦大学附属中山病院、3 南方医科大学南方病院、4 西安国際医学中心病院/北西大学、5 福建腫瘍病院/福建医科大学附属腫瘍病院、6 海南医科大学附属海南病院、7 千葉大学大学院医学研究院、8 高麗大学校九老病院、9 北京協和医学院、10 四川大学華西病院、11 イェール大学医学部、12 ヒューストン・メソジスト病院、13 広島大学大学院医系科学研究科、14 エクス・マルセイユ大学/地中海感染症大学病院研究所、マルセイユ国立大学病院、15 国立研究開発法人国立がん研究センター東病院、16 虎の門病院/沖中記念成人病研究所、17 USCノリス総合がんセンター、18 ハノーバー医科大学、トロント総合病院、UHNプリンセス・マーガレットがんセンター、19 メルク・アンド・カンパニー、20 エーザイ株式会社、21 UCLAデイビッド・ゲフィン医科大学院、22 マウント・サイナイ・アイカーン医科大学、バルセロナ大学、カタルーニャ先端研究所
DOI:10.1016/S0140-6736(24)02575-3
URL:https://www.sciencedirect.com/science/article/pii/S0140673624025753?via%3Dihub
【本件の詳細】
本研究は、切除不能な非転移性肝細胞がん患者において、標準治療であるTACEにレンバチニブとペムブロリズマブを追加した場合と、TACE+プラセボの併用療法を比較検討することを目的としました。この試験(LEAP-012)では、33カ国・地域の137施設において、切除不能な非転移性肝細胞がんで、TACEが適応となり、パフォーマンスステータス※8 が0または1、Child-Pugh分類※9 がAである患者を対象としました。患者は、参加施設、α-フェトプロテイン値※10、パフォーマンスステータス、ALBIグレード※11、腫瘍量により層別化され、TACEとレンバチニブ(体重60kg以上:12mg、体重60kg未満:8mg、1日1回)+ペムブロリズマブ静注(400mg、6週に1回、最長2年間)、またはマッチさせたデュアルプラセボ(経口および静注)のいずれかを受ける群に無作為に割り付けました(1:1)。主要評価項目は、RECISTv1.1※12 による無増悪生存期間および全生存期間、安全性は無作為に割り付けられ、いずれかの試験治療を少なくとも1回受けた全参加者において評価しました。
その結果、480人の患者が登録されTACE+レンバチニブ+ペムブロリズマブ(n=237)またはTACE+プラセボ(n=243、ITT集団)に無作為に割り付けられ、全員が少なくとも1回の試験薬投与を受けました。年齢中央値は66歳、480人中82人(17%)が女性、398人(83%)が男性でした。
治療後の無増悪生存期間の中央値は、レンバチニブ+ペムブロリズマブ群で14.6カ月、プラセボ群で10.0カ月となりました(ハザード比[HR]0.66[95%CI 0.51-0.84];p=0.0002)。レンバチニブ+ペムブロリズマブ群237例中69例(29%)、プラセボ群243例中82例(34%)が死亡し、24.0カ月全生存率はレンバチニブ+ペムブロリズマブ群75%(95%CI:68-80)、プラセボ群69%(95%CI:62-74)でした(HR 0-80[95%CI 0-57-1-11]; p=0.087)。
グレード3以上の治療関連有害事象は、レンバチニブ+ペムブロリズマブ群237人中169人(71%)、プラセボ群241人中76人(32%)に発現し、最も多かったのは高血圧(57人[24%]対18人[7%])と、血小板数減少(27人[11%]対15人[6%])でした。治療関連有害事象による死亡は、レンバチニブ+ペムブロリズマブ群で4例(2%)(肝不全、消化管出血、筋炎、免疫介在性肝炎による、それぞれn=1)、プラセボ群で1例(1%未満)(脳幹出血による)でした。
結論としてTACE+レンバチニブ+ペムブロリズマブによる治療は、TACE+プラセボと比較して、切除不能な非転移性肝細胞がん患者の無増悪生存期間を、有意にかつ臨床的に意義のある延長効果を示し、全生存期間も改善する傾向を示しました。本試験の結果、TACE+レンバチニブ+ペムブロリズマブは切除不能な非転移性肝細胞がん患者の標準治療になることが期待されます。
【研究代表者コメント】
工藤正俊(くどうまさとし)
所属:近畿大学医学部内科学教室(消化器内科部門)
職位:主任教授
学位:医学博士
コメント:LEAP-012試験は、我々の開発したレンバチニブにTACEを加えるLEN-TACE療法の有効な結果の延長線上で計画された多施設共同無作為化二重盲検第3相試験です。LEN-TACEに免疫チェックポイント阻害剤を加えることにより、LEN-TACEよりも更に良好な結果が期待できると考えました。主要評価項目は無増悪生存期間と全生存期間の2つですが、私が提案した試験デザインは、(1)レンバチニブとペムブロリズマブをTACTICS-L試験のデザインと同じく初回TACEの2-4週前に行うこと、(2)割付因子に腫瘍量(Up-to-6 criteria)を入れること、(3)同じく割付因子にALBI gradeを入れること、(4)割付因子にAFPを入れること、の4点でした。
まず(1)については、抗VEGF作用により1回目のTACEの効果が高まること、それにより無増悪生存期間延長効果が高まり、のみならず全生存期間も延長させる効果が期待できることです。(2)の腫瘍量については、「個数の少ない小型肝がん」と「個数が多数で大型の肝がん」ではTACEの後の無増悪生存期間は明らかに異なることから、均等に割り付けた方がより薬剤の効果そのものを判定できると考えました。また、(3)のALBI gradeは、肝機能の予備力を示す指標ですが、ALBI gradeは予後因子であることに加えて、ALBI grade 1とALBI grade 2ではレンバチニブの忍容性が異なることから、ALBI gradeを入れることによりレンバチニブの効果をより明確に評価できると考えました。(4)のAFPも、予後因子であることから割付因子に入れました。このような工夫により、全生存期間にも差を出しやすくなると考えて試験をデザインしました。
結果的にこのような試験デザインの工夫により、LEAP-012試験はpositive試験となりThe Lancetに掲載されることになりました。このTACE+レンバチニブ+ペムブロリズマブが承認され、実臨床で腫瘍が縮小した場合には、切除・Ablationなどの根治的治療を併用することにより、非転移性肝細胞がんの患者さんにおいても治癒をもたらすことができると期待しています。
【用語解説】
※1 肝動脈化学塞栓療法:transarterial chemoembolization(TACE)という。カテーテルで抗がん剤と血液の流れを止め、腫瘍への養分などの供給を断つ塞栓物質を注入して、がん細胞の増殖を抑える手法。
※2 免疫チェックポイント阻害剤:免疫細胞の力を保ち、がん細胞を攻撃する治療薬。
※3 無増悪生存期間:治療中や治療後に、がんが進行せず安定した状態の期間。
※4 全生存期間:抗がん剤の臨床試験において、試験登録日もしくは治療開始日から生存した期間のことを示す。亡くなった原因ががんであるかどうかに関係なく、がん以外の病気や交通事故などで亡くなっても、統計上は同じ死亡として取り扱われる。
※5 多施設共同無作為化二重盲検第3相試験:臨床試験のうち、第1相(少数の康な成人を対象)、第2相(少数の患者を対象)を経て、多施設に罹っている大人数の患者を対象とした試験で、研究者も患者もどちらが治療薬群かを把握していない臨床試験。
※6 TACTICS試験:TACEとソラフェニブの併用療法と、TACEのみを比較した第2相試験。Transarterial Chemoembolisation Therapy in Combination with Sorafenib as Compared with TACE Alone in Patients with Hepatocellular Carcinomaの略。
※7 第1相試験:臨床試験のうち、少数の健康な成人を対象としたもの。
※8 パフォーマンスステータス:全身状態の指標の一つで、日常生活における患者の制限の程度を5段階に分類したもの。
※9 Child-Pugh分類:肝臓の残された機能(肝予備能)を評価する分類法。この評価に基づき、治療法を決定する。
※10 α-フェトプロテイン値:肝臓の腫瘍マーカーの一つで、基準値よりも大幅に高い場合は肝臓がん、少し高い場合は肝炎や肝硬変などの疾患が疑われる。
※11 ALBIグレード:肝予備能の評価で、Child-Pughに代わる分類法。総ビリルビン、アルブミンという2種類の検査データのみを用いて統計学的に評価する方法。
※12 RECISTv1.1:平成21年(2009年)に発表された、固形がんの治療効果判定のための新ガイドライン。
【関連リンク】
医学部 医学科 教授 工藤正俊(クドウマサトシ)
https://www.kindai.ac.jp/meikan/569-kudou-masatoshi.html