半数体生物の性染色体上の性決定遺伝子を解明 ―コケがもつ現生生物最古の起源の性染色体―

【概要】
京都大学大学院生命科学研究科の岩崎美雪氏(博士後期課程学生)、梶原智明氏(博士後期課程学生)、安居佑季子准教授、吉竹良洋助教、山岡尚平准教授、河内孝之教授らの研究グループは、東京理科大学理工学部応用生物科学科の西浜竜一教授、朽津和幸教授、国立遺伝学研究所中村保一教授、近畿大学生物理工学部大和勝幸教授らの研究グループおよびオーストリア・ドイツ・オーストラリアの研究グループとの国際共同研究により、半数体注※3において性別が決まるコケ植物のゼニゴケから性決定遺伝子を同定しました。
性染色体※1 と性決定因子※2 の研究は二倍体生物※3 (例えばXYがオス、XXがメスになる哺乳類)で進んでいますが、遺伝的な振る舞いが大きく異なる半数体生物※3 における性染色体上の性決定遺伝子は不明でした。今回、生活環の大半を半数体で過ごす苔類ゼニゴケのメスの性染色体の一次構造を染色体レベルで明らかにし、更にメスの性染色体上の遺伝子機能解析の実験から雌性化遺伝子(フェミナイザー)を同定しました。フェミナイザーはオスのゼニゴケをメスに転換する能力をもちます。更に、この遺伝子は有性生殖を誘導する役割も有しており、この機能はオスの性染色体に存在する相同遺伝子と共通していました。これは二倍体生物の性決定遺伝子が性決定に特化した機能をもつこととは対照的です。また、今回同定したフェミナイザー遺伝子はこれまでに知られるどの性決定遺伝子よりも起源が古く、苔類が地球に出現した4億3000万年前に性染色体が誕生していたことを示しました。
本成果は2021年11月3日に国際誌「Current Biology」にオンライン掲載されました。
【背景】
多くの生物では性染色体※1 にコードされる性決定遺伝子※2 により遺伝的な性別が決まります。X染色体とY染色体をもつ哺乳類を例にすると、Y染色体上に性決定遺伝子があり、XY染色体をもつ個体がオス、XX個体がメスになります。生物界にはY染色体がオスの性を決定する生物のほかに、W染色体がメスの性を決定するZW染色体の性決定システムも知られています。常染色体を起源として誕生したとされる性染色体ペアのうち、性を決定する染色体(Y染色体やW染色体)は進化の過程で性決定機能に特化して、それ以外の機能をもつ遺伝子を失って小型化する傾向があるのに対して、雌雄ともに存在する性染色体(X染色体やZ染色体)は生存に重要な多くの遺伝子を維持することが知られています(性染色体進化の非対称性)。このような性染色体進化や性決定遺伝子の研究は、近年性決定遺伝子が明らかにされたカキ、ポプラ、キウイ、アスパラガスなどの植物も含めて主に二倍体生物※3 で研究が進んでいます。一方、自然界には二倍体で性決定を行う生物ばかりではなく、多くの藻類やコケ植物のように半数体※3 で性を決定する生物がいます。半数体生物の性決定と性染色体進化は、非対称性を示す二倍体のものとは本質的に異なることが予想されていましたが、性決定遺伝子も含めてその実態は不明でした。
コケ植物は、種子植物と同じ陸上植物に分類されますが、生活環の大半を過ごす半数体世代で性の分化が起こるという特徴があります。コケ植物のうち苔(タイ)類の多くは雌雄異株で性染色体をもち(メスU染色体、オスV染色体)、卵や精子といった雌雄の配偶子を作るために造卵器か造精器のどちらかを発生させます。植物の性染色体は今から100年以上前にこのようなコケ植物の細胞を顕微鏡で観察することにより発見されました。1930年代には染色体観察から雌雄の性染色体の両方を偶然にもつゼニゴケはメスになることが示され、メスの性染色体に雌性化因子(フェミナイザー)が存在することが予想されていました。しかし、その当時は遺伝子に迫る研究は不可能でした。そこで、我々は近年モデル生物としての実験基盤が整備された苔類ゼニゴケを材料にU染色体上の性決定遺伝子を同定し、半数体生物の性決定と性染色体進化という残された謎に迫ることを目指しました。
【研究手法・成果】
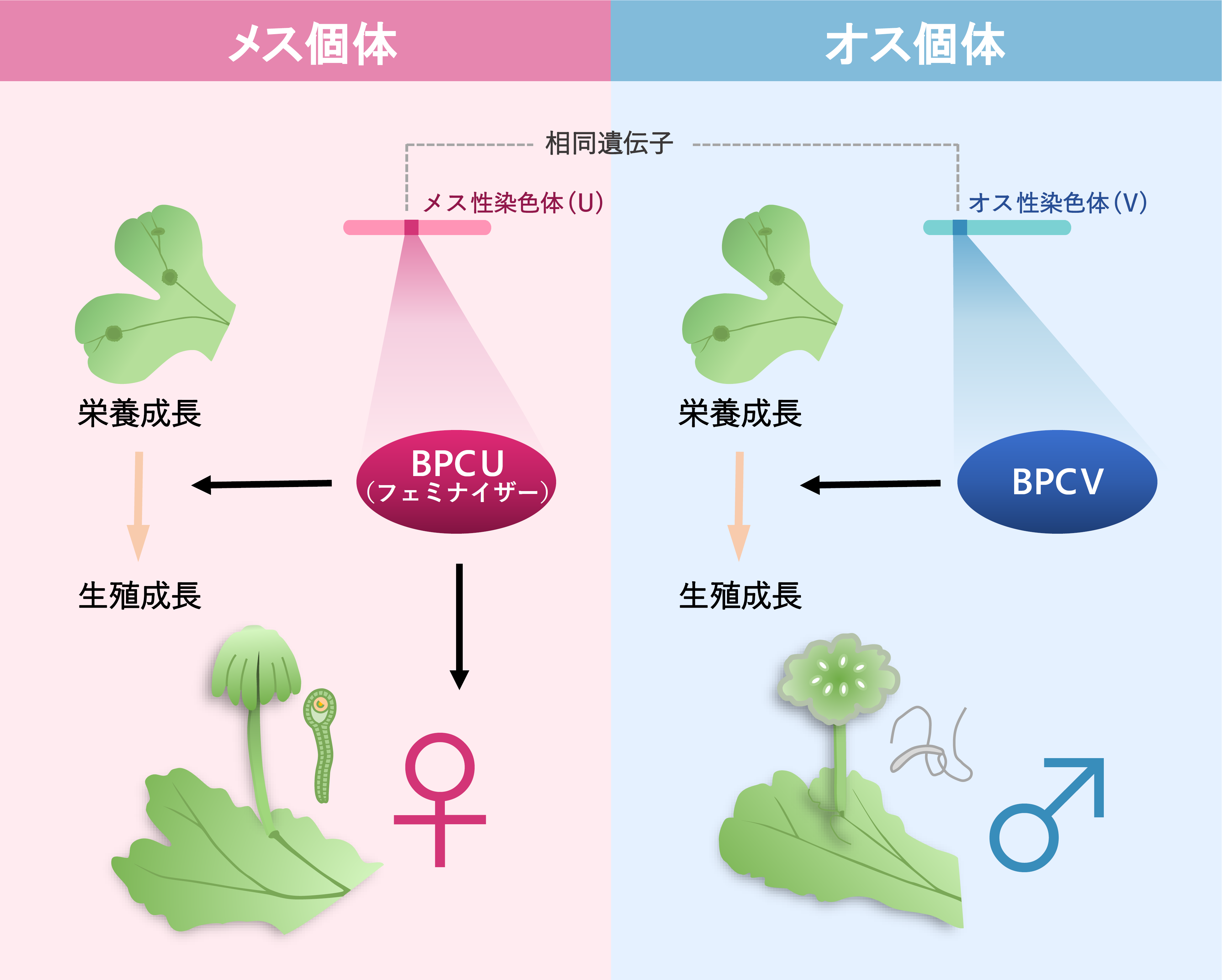
ゼニゴケには雌雄の性染色体(U染色体、V染色体)があります。次世代塩基配列解析法※4 を用いて、これまでに得られていたドラフトゲノム配列を染色体レベルで連結しました。その結果、U染色体とV染色体には47個と93個の遺伝子が座乗することを明らかにしました(図1)。

次にU染色体上の遺伝子のうち遺伝子発現制御に関わることが予想される遺伝子についてゲノム編集技術を用いて破壊し、フェミナイザー遺伝子を探索しました。得られた株のなかで、植物に特異的な転写因子をコードするBASIC PENTACYSTEINE ON THE U CHROMOSOME (BPCU)と名付けた遺伝子を破壊した株※5 はU染色体をもつにも関わらず、造精器を含む雄器托※6 を形成しました。このBPCU遺伝子をオス株に導入し発現させたところ、本来オスである植物が造卵器を含む雌器托※6 を形成しました(図2)。つまり、BPCU遺伝子が雌性化に必要かつ十分な機能を与えるフェミナイザー遺伝子であることになります。

従来、性決定遺伝子の機能は性決定に特化するとされていました。驚いたことにこのBPCU遺伝子には、オスの性染色体に相同性を示すBPCV遺伝子が存在しました。これらの遺伝子の機能について遺伝子破壊株を用いて調べたところ、両方の遺伝子が共通して有性生殖の誘導に重要な役割をもつことを見出しました。しかし、オスがもつBPCV遺伝子にはフェミナイザーの機能はありませんでした。
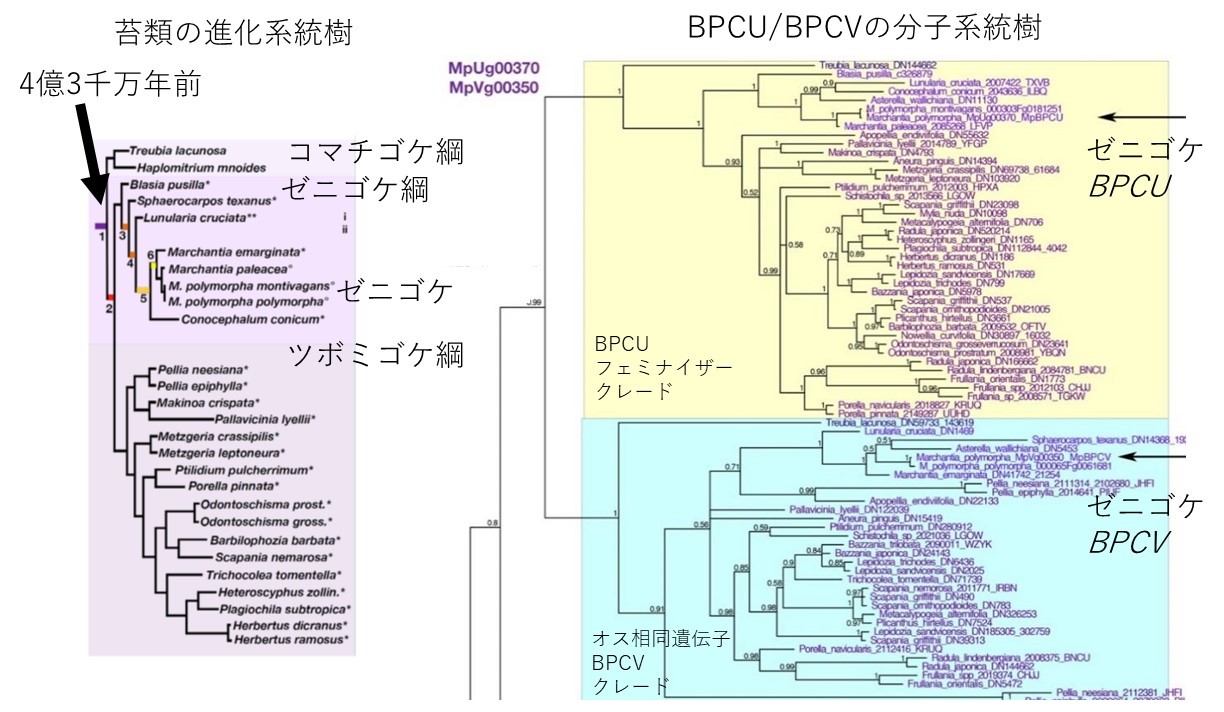
最後に、フェミナイザー遺伝子がいつ誕生したかを、この遺伝子の分子系統樹※7 の解析から調べました。陸上植物にはBPC遺伝子は広く分布しますが、苔類は基本的にはBPCU型とBPCV型をもつことがわかりました(図3)。これは、地球上で苔類が誕生したとされる4億3000万年前にはすでに遺伝子の機能分化が起こっていたことを示唆しています。これまでに知られている現生生物の性決定遺伝子として最も古い起源と言えます。

【波及効果、今後の予定】
性染色体は常染色体を起源とするとされ、性決定因子の誕生をきっかけに、相同組換えの抑制や性決定因子が座乗する染色体の縮退が起こるとされていました。これは、メスがXXとオスがXYをもつ哺乳類の例のような二倍体生物からの知見であり、対となる性染色体が雌雄に存在するために引き起こされる現象と理解されていました。半数体の性染色体進化は二倍体のものとは大きく異なることが予想されていましたが、これまでは性決定因子も同定されていない状況でした。今回の研究は、生物の性決定機構を大別したときに謎として残されていた半数体生物の性決定因子を同定し、性染色体進化を明らかにした点で大きな意義があります。今回単離した性決定因子は、染色体の活性化と抑制の状態を制御する因子であると予想されます。今後は、今回同定した遺伝子を介して、性決定や有性生殖誘導が行われる遺伝子発現制御の仕組みを明らかにしていく予定です。
【研究プロジェクトについて】
この研究は、日本学術振興会 科学研究費補助金 基盤研究(S)(17H07424、代表 河内 孝之)、日本学術振興会 二国間交流事業 二国間共同研究(JSBP120192003、代表 河内 孝之)、先進ゲノム支援(16H06279)等により支援されました。
【用語解説】
※1 性染色体
雌雄によって形態あるいは数が異なる染色体(正確には性決定に関与する染色体)。ヒトでは23番目の染色体セット。雌雄で違いがない常染色体と区別する用語。性染色体は常染色体を起源とし、性決定遺伝子が誕生したあとで、遺伝子の欠失や重複配列の増加などを経ることが多い。二倍体生物では、XX/XYやZW/ZZといった性染色体の組みあわせで性が決定される。
※2 性決定遺伝子
性決定(生物個体において性別が決まること)に関与する遺伝子。多くの場合は性染色体にコードされる。
※3 半数体と二倍体
ゲノム1セットをもつ生物や細胞を半数体、2セットもつものを二倍体と呼ぶ。卵や精子といった配偶子は半数体である。多細胞性の藻類やコケ植物は、配偶子を作り出す世代(配偶体世代)が生活環のなかの大半を占め、性決定も配偶体世代で行われる。維管束植物では、配偶体世代が短縮され、減数分裂により最終的に胞子を作り出す胞子体世代(二倍体)が生活環の大半を占める。
※4 次世代塩基配列解析法
ゲノムを解析する手法は21世紀になって大きく発展した。今回は、長鎖DNAを解読できる技術(ロングリード法)と染色体の立体構造を解析する方法(Hi-C法)を用いて、染色体レベルで連結した塩基配列を得ることに成功した。
※5 遺伝子破壊株
遺伝子組換え法を用いて特定の遺伝子を破壊して作成する。従来は相同組換えを利用したジーンターゲッティング法が主流であったが、現在ではゲノム編集により簡便に特定の遺伝子に変異を導入することが可能となった。
※6 雌器托と雄器托
ゼニゴケの仲間に特徴的な構造。俳句の世界ではコケの花と呼ばれることもあるが、花ではなく、造卵器や造精器を含む構造。葉状体の先端に形成され、メスは破れ傘状の構造をもつ雌器托を、オスは円盤状の構造をもつ雄器托をもつ。
※7 分子系統樹
生物が共通の祖先から分かれて誕生することを反映させて進化関係を枝状に表したものを系統樹と呼ぶ。この系統樹を遺伝子やタンパク質の配列比較をもとに作成したものを分子系統樹と呼ぶ。
【研究者のコメント】
100年以上前に植物の性染色体の発見の端緒となったコケ植物から半数体生物の性決定因子が同定できたことは感慨深いです。進化の過程で性決定機能に特化していくと考えられていた性決定因子が、半数体のシステムでは対となる性染色体上の相同遺伝子と共有する機能も保持しているという発見や、この性決定機構が現生生物として最古の起源をもつことなど、予想外の発見もありました。生物の進化と多様性には驚かされます。
【論文タイトルと著者】
タイトル:
Identification of the sex-determining factor in the liverwort Marchantia polymorpha reveals unique evolution of sex chromosomes in a haploid system
(ゼニゴケにおける性決定因子の同定により明らかにされた半数体システムの性染色体の独特な進化)
著 者:
岩崎 美雪1、梶原 智明1、安居 佑季子1、吉竹 良洋1、宮崎 基1、川村 昇吾1、末次 憲之1、西浜 竜一1,2、山岡 尚平1、Dierk Wanke3、橋本 研志2、朽津 和幸2、Sean A. Montgomery4、Shilpi Singh5、谷澤 靖洋6、矢倉 勝6、 望月 孝子6、坂本 美佳6、中村 保一6、Chang Liu7、Frédéric Berger4、大和 勝幸8、John L. Bowman5*、河内 孝之1*
*共同責任著者
1京都大学生命科学研究科
2東京理科大学理工学部
3ルートビッヒマクシミリアン大学、ドイツ
4グレゴールメンデル研究所、オーストリア
5モナシュ大学、オーストラリア
6情報・システム研究機構国立遺伝学研究所
7ホーエンハイム大学、ドイツ
8近畿大学生物理工学部
掲載誌 :Current Biology
DOI :https://doi.org/10.1016/j.cub.2021.10.023
(英文 著者と所属)
Title : Identification of the sex-determining factor in the liverwort Marchantia polymorpha reveals unique evolution of sex chromosomes in a haploid system
Authours : Miyuki Iwasaki1, Tomoaki Kajiwara1, Yukiko Yasui1, Yoshihiro Yoshitake1, Motoki Miyazaki1, Shogo Kawamura1, Noriyuki Suetsugu1, Ryuichi Nishihama1,2, Shohei Yamaoka1, Dierk Wanke3, Kenji Hashimoto2, Kazuyuki Kuchitsu2, Sean A. Montgomery4, Shilpi Singh5, Yasuhiro Tanizawa6, Masaru Yagura6, Takako Mochizuki6, Mika Sakamoto6, Yasukazu Nakamura6, Chang Liu7, Frédéric Berger4, Katsuyuki T. Yamato8, John L. Bowman5* and Takayuki Kohchi1,9*
1Graduate School of Biostudies, Kyoto University, Kyoto 606-8502, Japan.
2Faculty of Science and Technology, Tokyo University of Science, Noda, Chiba 278-8510, Japan.
3Department Biologie I, Ludwig-Maximilians-University (LMU), München, D-80638, Germany.
4 Gregor Mendel Institute (GMI), Austrian Academy of Sciences, Vienna Biocenter (VBC), 1030 Vienna, Austria.
5School of Biological Sciences, Monash University, Melbourne, Victoria 3800, Australia.
6National Institute of Genetics, Research Organization of Information and Systems, Mishima, Shizuoka 411-8540, Japan.
7Institute of Biology, University of Hohenheim, Stuttgart, D-70599, Germany.
8Faculty of Biology-Oriented Science and Technology (BOST), Kindai University, Kinokawa, Wakayama 649-6493, Japan.
9Lead contact
【関連リンク】
生物理工学部 生物工学科 教授 大和 勝幸(ヤマト カツユキ)
https://www.kindai.ac.jp/meikan/499-yamato-katsuyuki.html