病原細菌サルモネラは宿主ポリアミンを利用し、病原因子III型分泌装置を構築することにより、感染する — ポリアミンの制御は、細菌感染を抑制する可能性を発見 —

北里大学薬学部微生物学教室の三木剛志講師、大阪大学大学院生命機能研究科の南野徹准教授、近畿大学生物理工学部食品安全工学科の栗原新准教授、城西大学薬学部生体分析化学研究室の植村武史准教授の研究グループは、病原細菌サルモネラ※1 が宿主のポリアミン※2 を利用し、病原因子III型分泌装置を構築することにより、感染することを明らかにしました。
ポリアミンは、アミノ基を2つ以上持つ炭化水素であり、代表的なものにはプトレッシン、スペルミジン、スペルミンがあげられます。生体にある"アミン"というとヒスタミンやアセチルコリンなどの微量で強い生理活性を持つホルモンや神経伝達を連想する人が多いのではないでしょうか。実は、ほとんどの細胞に最も多く存在する生体アミンは、ポリアミンです。ポリアミンは生理的なpHの環境では、その構造的な特徴により正電荷を持つため、細胞内において負電荷を持つ核酸やリン脂質などと結合することによって、多様な生体反応に影響を及ぼしています。ポリアミンは病原細菌の病原性発現に関与することが報告されていましたが、その全貌については十分に理解されていませんでした。
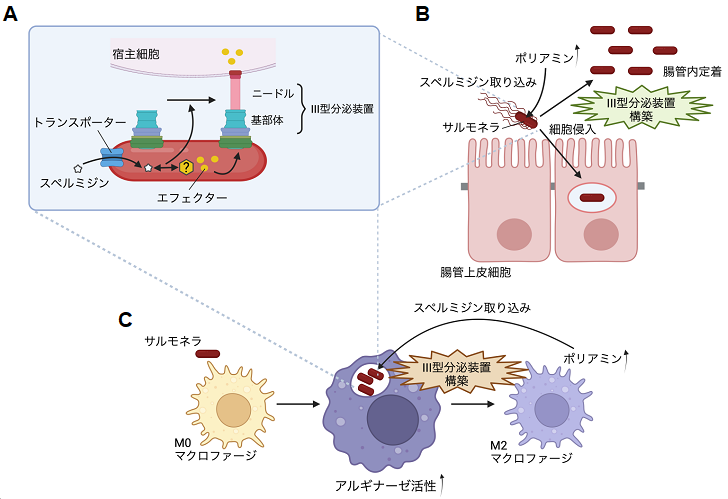
本研究では、腸管系病原細菌であるサルモネラ(ネズミチフス菌)※1 とそのマウス感染モデルを用いて、ポリアミンが多くの病原細菌において主要な病原因子であるIII型分泌装置※3 の構築に関わることによって、感染を促進することを明らかにしました。細菌のポリアミン量は厳密に制御されていますが、外界、すなわち宿主からのポリアミンの取り込みが重要であり、その恒常性が失われたネズミチフス菌は、マウスに対する感染能が著しく低下しました。また、それは、主要な病原因子であるIII型分泌装置を構築できないことが理由であることを発見しました。宿主のポリアミン合成の律速酵素の阻害薬であるエフロルニチン※4 を飲水したマウスでは、ネズミチフス菌の感染菌数が減少し、一方、スペルミジンを飲水したマウスにおけるネズミチフス菌の感染能は上昇しました。ネズミチフス菌の感染はL-アルギニンをL-オルニチンと尿素に加水分解するアルギナーゼの活性を亢進させ、宿主のポリアミン量を上昇させることにより、感染に有利な環境を作り上げていることがわかりました。本研究結果は、宿主のポリアミン合成の阻害が病原細菌の感染を制御する可能性を示唆するものであります。さらに、III型分泌装置はグラム陰性の病原細菌に共通した病原因子であることから、ポリアミンによるIII型分泌装置制御メカニズムを理解することは、細菌感染症に対する新たな薬剤開発の分子基盤になることが大いに期待されます。
本研究成果は、2024年8月5日付で、国際科学誌『PLOS Biology』にオンライン掲載されました。
【研究成果のポイント】
●外界からの取り込みによるサルモネラのポリアミン恒常性は、マウスに対する病原性発現に重要である。
●外界からの取り込みによるサルモネラのポリアミン恒常性は、細胞への侵入や細胞内生残・増殖に重要である。
●ポリアミン(特に、スペルミジン)は病原因子III型分泌装置の針状構造(ニードル)の構築に必要である。
●宿主のポリアミン合成を抑制する薬剤エフロルニチンは、サルモネラのマウス感染と細胞内増殖を抑制する。
●サルモネラの感染は、アルギナーゼの活性を高め、宿主のポリアミン量の増加を招く。
●宿主のポリアミン量の増加は、サルモネラの感染性を高めてしまう。
【研究の背景】
病原細菌は感染宿主の環境変化に応じ、適応することによって、感染を成立させます。宿主内の代謝産物や、それらに依存したpH変化など、多くの環境因子が病原細菌の病原因子の機能発現に関わります。本研究で注目したポリアミンは宿主細胞内のアミンにおいて最も多く含まれるもので、細胞の増殖活性に関わるなどの多様な影響を及ぼす生体因子として知られていました。細菌においても、同様に、増殖因子として機能する一方、病原性の発現にも関与することが報告されていました。しかし、これまでの研究では、そのポリアミンによる病原性制御がどの程度、感染性に影響を及ぼすかは不明でした。
【研究内容と成果】
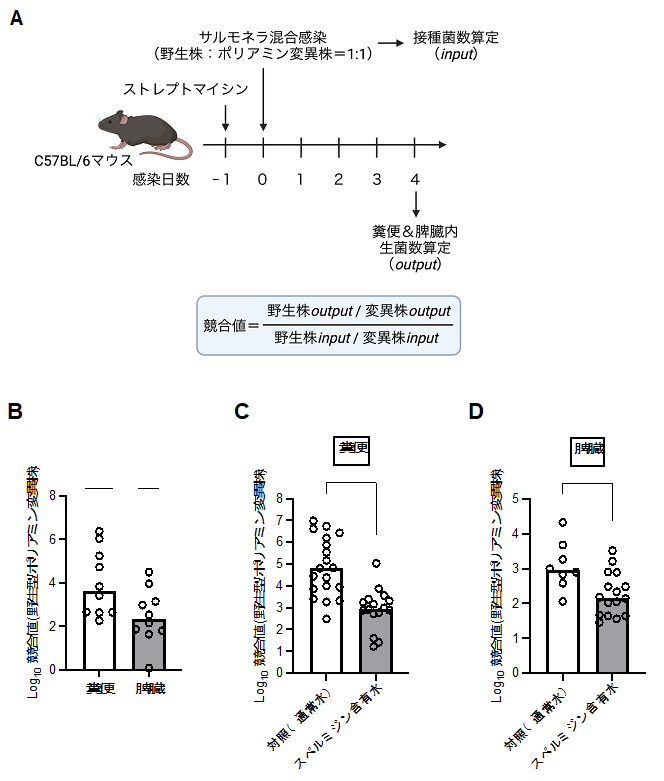
まず、サルモネラのポリアミン恒常性が感染性に関与するかを調べるために、ネズミチフス菌のポリアミン合成および取り込みに関与する遺伝子群を欠失した変異株(以下、ポリアミン変異株)を作製し、そのマウスに対する病原性について、野生株と比較しました。その結果、感染マウスの糞便中や脾臓内のポリアミン変異株の生菌数は、同時感染した野生株と比較して、著しく減少しました(図2)。一方、スペルミジン含有飲水により、これらのポリアミン変異株の生菌数減少は回復しました(図2)。これらの結果は、外界からの取り込みによるサルモネラのポリアミン恒常性は本菌の病原性発現に重要であることを示唆しています。

次に、細胞レベルでの影響を調べたところ、ポリアミン変異株の細胞への侵入および細胞内増殖能が減弱していました。これらの細胞に対する反応は、ネズミチフス菌の病原性発現に重要であり、III型分泌装置によるエフェクター※5 の細胞内移行に依存しています。
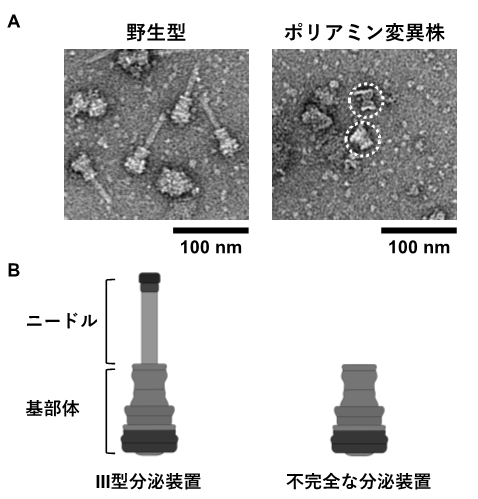
そこで、次に、ネズミチフス菌のエフェクター移行量を調べた結果、III型分泌装置が構築されない変異株と同様に、ポリアミン変異株では、エフェクターはほとんど移行しませんでした。さらに、III型分泌装置を精製したところ、ポリアミン変異株では針状構造(ニードル)のない不完全な構造体(基部体のみ)が観察されました(図3)。これらの結果は、ネズミチフス菌のポリアミン恒常性はIII型分泌装置の構築に必要であり、エフェクターの宿主内移行に関与することを示唆しています。

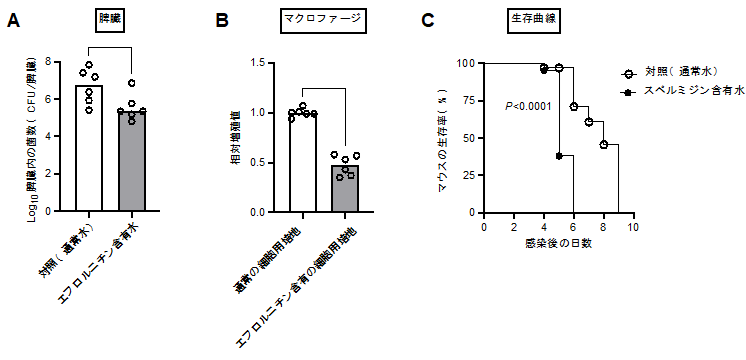
宿主内ポリアミンレベルとサルモネラ感染性の関係を明らかにするために、宿主ポリアミン合成の律速酵素であるオルニチン脱炭酸酵素の阻害薬エフロルニチンを、マウス飲水に加えました。エフロルニチン飲水マウスにおけるネズミチフス菌の脾臓内生菌数は、通常水を飲水した対照マウスと比較して、有意に減少していました(図4)。さらに、細胞培養液にエフロルニチンを加えると、マクロファージ様細胞に感染したネズミチフス菌の細胞内増殖能が減少しました(図4)。一方、スペルミジン含有水を飲水したマウスでは、ネズミチフス菌の感染能が上昇しました(図4)。さらに、ネズミチフス菌が感染したマウスのポリアミン量を測定した結果、感染していないマウスと比較して、糞便中および脾臓内のポリアミン量は明らかに上昇しました。これは、ネズミチフス菌感染により、アルギニンからオルニチン産生を促すアルギナーゼ活性の上昇が一因でした。これらの結果は、宿主のポリアミンレベルとサルモネラ感染の関係性を明らかにしたものであり、驚くべきことに、サルモネラは戦略的に感染宿主のポリアミンレベルを上昇させ、感染に有利となる状況を作り出している可能性を示唆するものです。また、宿主のポリアミン量を抑制することは感染制御につながることを示唆しています。

【今後の展望】
エフロルニチンは、原虫感染を原因とするアフリカ睡眠病で知られるトリパノソーマ症の治療薬として使用されています。本研究により、エフロルニチンは細菌感染症に対しても有効である可能性が示唆されました。また、エフロルニチンのようなポリアミンの合成阻害に加え、細胞内へのポリアミン輸送を抑制することによる感染制御のアプローチも期待されます。一方、III型分泌装置はグラム陰性の病原細菌に広く分布する共通した病原因子であることから、スペルミジンによるIII型分泌装置の構築メカニズムを明らかにすることは、病原性の発現を抑える、新たな感染症制御薬(次世代抗菌薬)の開発につながる分子基盤になることが期待されます。
【論文情報】
掲載誌:PLOS Biology
論文名:Salmonella Typhimurium exploits host polyamines for assembly of the type 3 secretion machinery
著者 :三木剛志*、植村武史、木下実紀、網優太、伊藤雅洋、岡田信彦、古地壯光、栗原新、羽田健、南野徹*、金倫基 (*責任著者)
DOI :10.1371/journal.pbio.3002731
【用語解説】
※1 サルモネラ/ネズミチフス菌:サルモネラ属細菌(Salmonella enterica)はグラム陰性の病原細菌であり、汚染された卵や肉などから人に感染し、食中毒を起こす。ネズミチフス菌(Salmonella enterica serovar Typhimurium)はサルモネラ属の主要な食中毒菌であるが、マウスに感染した場合、局所(腸管)に留まらず、全身性の感染を起こす。
※2 ポリアミン:分子構造内に2つ以上のアミノ基を持つ炭化水素化合物。原核生物から高等動植物に至るまで、ほぼすべての生物が高濃度(数mMから数10mM)で細胞質に有している。生理学的なpH下では正電荷を持つため、核酸、リン酸化タンパク質、リン脂質、ATPなどの負電荷をもつ分子と弱く結合し、多様な細胞機能を調節する。
※3 III型分泌装置:菌体から突出した注射針様の構造を持つタンパク質分泌装置。基部体とニードル部分に分けられる。ニードル先端部が宿主細胞膜上に孔を形成し、エフェクターと呼ばれる基質タンパク質(以下の※5 を参照)を宿主細胞内に注入する。
※4 エフロルニチン:オルニチン脱炭酸酵素の活性を阻害し、オルニチンからのプトレッシン合成を抑制する。アフリカ睡眠病の治療薬として使用されている。
※5 エフェクター:III型分泌装置より菌体外に分泌、あるいは宿主の細胞質へ注入され、宿主因子と相互作用することによって、宿主の生理機能を撹乱する。その結果、病原細菌の感染成立へと導かれていく。
【関連リンク】
生物理工学部 食品安全工学科 准教授 栗原新(クリハラシン)
https://www.kindai.ac.jp/meikan/2313-kurihara-shin.html