筋萎縮性側索硬化症と前頭側頭型認知症の新たな治療戦略への期待 異常なポリペプチドの合成を制御するメカニズムを発見

近畿大学医学部(大阪府大阪狭山市)内科学教室(脳神経内科部門)主任教授 永井義隆、同特別研究派遣学生 藤野雄三(京都府立医科大学大学院医学研究科脳神経内科学大学院生)同研究員上山盛夫(執筆当時)の研究グループは、大阪大学大学院医学系研究科(大阪府吹田市)神経内科学教授 望月秀樹、京都府立医科大学大学院医学研究科(京都府京都市)脳神経内科学特任教授 水野敏樹、東京工業大学科学技術創成研究院(神奈川県横浜市)細胞制御工学研究センター教授 田口英樹らとの共同研究で、神経難病である筋萎縮性側索硬化症(ALS)と前頭側頭型認知症(FTD)の原因となる異常なポリペプチド※1 の合成を、FUS※2 というタンパク質が制御することを発見しました。さらに、FUSを含む一群のタンパク質がALSやFTDに対して治療効果をもたらすことを、疾患モデルショウジョウバエを用いて明らかにしました。本研究により、ALSとFTDの新たな治療法の開発につながると期待できます。
本件に関する論文が、令和5年(2023年)7月18日(火)16:00(日本時間)に、生物学領域の国際的な学術誌"eLife(イーライフ)"にオンライン掲載されました。
【本件のポイント】
●ALSとFTDの原因となる異常なポリペプチドの合成を、タンパク質FUSが制御することを発見
●FUSを含む一群のタンパク質がALSやFTDに対して治療効果を発揮することを、疾患モデルショウジョウバエを用いて証明
●異常ポリペプチドを原因とするALSやFTDに対する、新たな治療法開発への応用に期待
【本件の背景】
ALSは、全身の筋肉が急速に衰えていく神経疾患、FTDはアルツハイマー型認知症やレビー小体型認知症の次に多い、変性性認知症※3 です。これらの神経難病は、まだ原因が十分には解明されておらず、根本的な治療法も開発されていません。
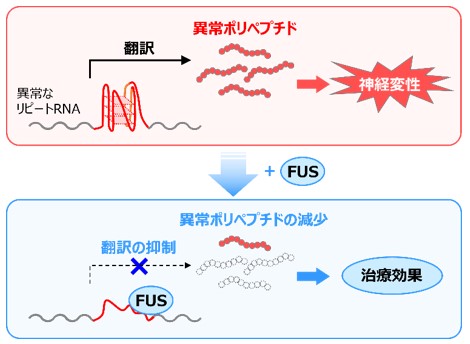
近年、ALSおよびFTDの最も多い遺伝的な原因として、C9orf72という遺伝子の変異が報告されました。このC9orf72遺伝子の領域内には、「GGGGCC」というDNA6塩基(G:グアニン、C:シトシン)が複数回繰り返された配列が存在しており、通常は2~23回の繰り返しであるのに対し、ALSやFTDの患者では700~1600回と、繰り返し配列が異常に長く連なっています。この異常に長い繰り返し(リピート)配列を持つ遺伝子から転写※4 された異常なリピートRNA※5 は、異常なポリペプチドに翻訳※6 され、神経細胞の機能障害や細胞死の原因になると考えられています。
【本件の内容】
研究グループは、異常なポリペプチドを合成する翻訳機構を制御することが、ALSおよびFTDの治療に有効なのではないかと考え、実験を行いました。
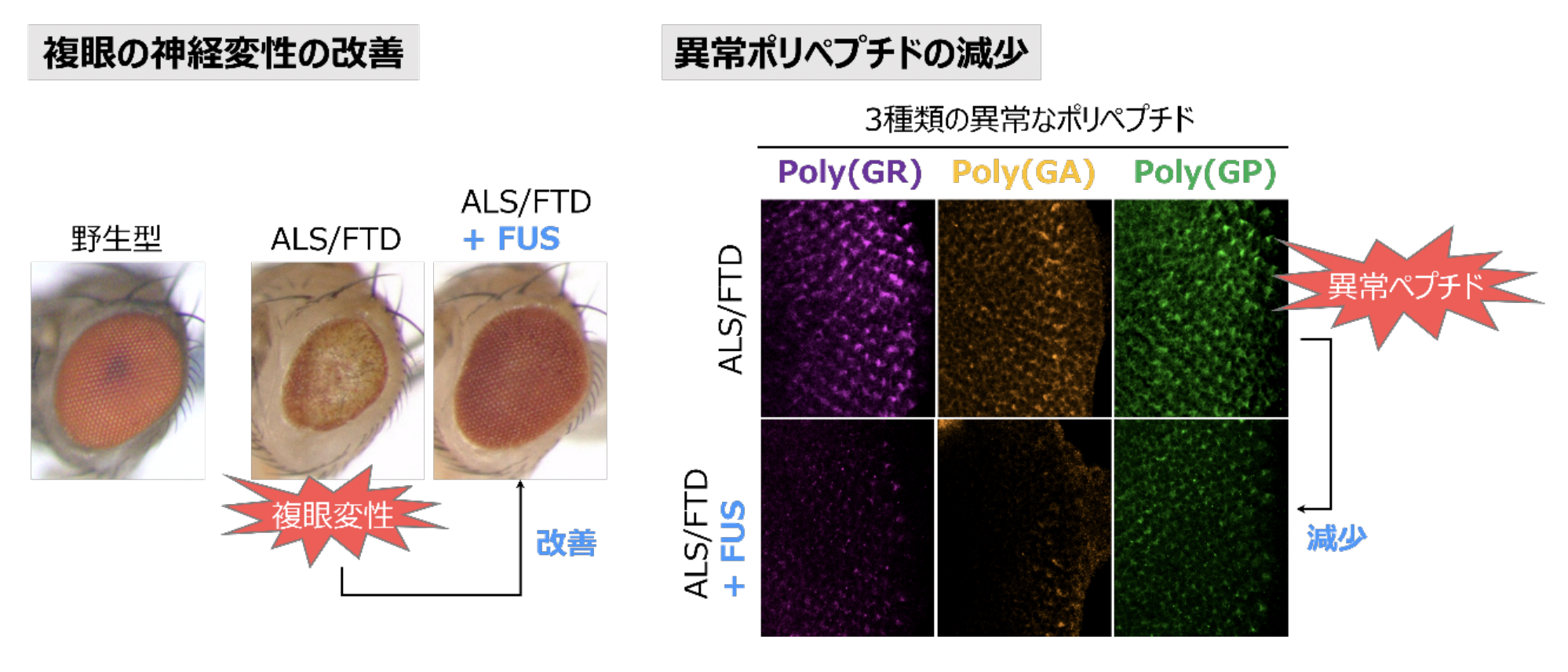
まず、異常なポリペプチドを合成する遺伝子をショウジョウバエに導入し、神経変性を起こすALSおよびFTDのモデルショウジョウバエを作成しました。次に、異常なリピートRNAに結合することが知られている18種類のタンパク質に着目して、神経変性への影響をスクリーニングしました。その結果、FUSというタンパク質が、異常なリピートRNAに結合することで、翻訳を制御して異常なポリペプチドの量を減少させ、ALS/FTDモデルショウジョウバエの神経変性を抑制することを明らかにしました(図)。さらに、FUS以外の一群のタンパク質についても、同様に翻訳を制御して異常なポリペプチドを減少させることで、神経変性を抑え治療効果を発揮することを証明しました。
本研究成果により、異常なリピートRNAに結合して、異常なポリペプチドの合成を減少させる分子による、ALSおよびFTDの新たな治療法開発への可能性が示されました。遺伝子中の別の繰り返し配列の異常伸長は、ALSやFTD以外にも脊髄小脳失調症※7 などの神経難病の原因にもなることが知られています。本研究成果を足がかりとして、これらの疾患についても同様に、異常なリピートRNAからの翻訳を制御して異常なポリペプチドを減少させることで、神経変性を抑制し、治療効果が発揮できることが期待されます。

【論文概要】
掲載誌:eLife(インパクトファクター:8.713@2021)
論文名:FUS regulates RAN translation through modulating the G-quadruplex structure of GGGGCC repeat RNA in C9orf72-linked ALS/FTD
(FUSは、C9orf72関連ALS/FTDにおいて、異常なGGGGCCリピートRNAのグアニン四重鎖構造を変化させることで、RAN翻訳を制御する)
著者:藤野雄三1,2、上山盛夫1,3,4、石黒太郎4,5、小澤大作1,3、伊藤隼人6、杉木俊彦7、村田亜沙子8、石黒亮9、Tania F. Gendron10、森康治11、徳田栄一12、田港朝也1,3、今野卓哉13、小山哲秀13、河邉有哉11、武内敏秀3,14、古川良明12、藤原敏道7、池田学11、水野敏樹2、望月秀樹15、水澤英洋5、和田圭司4、石川欽也5、小野寺理13、中谷和彦8、Leonard Petrucelli10、田口英樹6,16、永井義隆1,3,4,15※ ※ 責任著者
所属:1 近畿大学医学部内科学教室(脳神経内科部門)、2 京都府立医科大学大学院医学研究科脳神経内科学、3 大阪大学大学院医学系研究科神経難病認知症探索治療学寄附講座、4 国立精神・神経医療研究センター神経研究所疾病研究第四部、5 東京医科歯科大学脳神経病態学、6 東京工業大学生命理工学院、7 大阪大学蛋白質研究所、8 大阪大学産業科学研究所、9 法政大学マイクロ・ナノテクノロジー研究センター、10 メイヨークリニック神経科学部門、11 大阪大学大学院医学系研究科精神医学、12 慶応義塾大学理工学部化学科、13 新潟大学脳研究所脳神経内科、14 近畿大学ライフサイエンス研究所、15 大阪大学大学院医学系研究科神経内科学、16 東京工業大学科学技術創成研究院細胞制御工学研究センター
【研究代表者のコメント】
永井義隆(ながいよしたか)
所属 :近畿大学医学部医学科内科学教室(脳神経内科部門)
職位 :主任教授
学位 :博士(医学)
コメント:C9orf72遺伝子内のGGGGCC繰り返し配列の異常は、欧米人では最も多い筋萎縮性側索硬化症および前頭側頭型認知症の原因遺伝子異常です。他にも、CTGやCGG、TGGAAなどの繰り返し配列の異常が、脊髄小脳失調症や脆弱X関連振戦/失調症候群などの神経変性疾患の原因として見つかっており、これらはリピート(繰り返し)病と呼ばれています。今回の研究は、このような繰り返し配列を持つ異常なリピートRNAからの翻訳を制御して、異常なポリペプチドの量を減少させるタンパク質を初めて発見したものであり、同じような方法で脊髄小脳失調症などの他の疾患の治療法開発につながる可能性にも期待しています。
【研究支援】
本研究は、JSPS科学研究費助成事業学術変革領域研究(A)(20H05927)、同基盤研究(B)(21H02840)、およびAMED難治性疾患実用化研究事業(JP20ek0109316)などの一環として行われました。
【用語解説】
※1 ポリペプチド:多数のアミノ酸が化学結合によりつながって形成される高分子。
※2 FUS:RNAやDNAに結合するタンパク質。RNAやDNAが関与するさまざまな生体反応の調整を行っている。
※3 変性性認知症:神経細胞の機能障害や細胞死により引き起こされる認知症。
※4 転写:DNAからRNAが合成されること。DNA上の遺伝情報をもとにタンパク質を合成する際、いったんDNAからRNAに情報をコピーすることをいう。
※5 RNA:DNAとよく似た化学構造を持つ物質(リボ核酸)で、DNAを鋳型として合成される。
※6 翻訳:RNAに転写された遺伝情報をもとに、タンパク質を合成すること。
※7 脊髄小脳失調症:小脳や脊髄に進行性の神経変性を引き起こし、運動障害など多様な神経症状を来す神経難病の総称。一部の患者ではCTG、TGGAAなどの繰り返し配列の異常な伸長が原因となる。
【関連リンク】
医学部 医学科 教授 永井 義隆(ナガイ ヨシタカ)
https://www.kindai.ac.jp/meikan/2687-nagai-yoshitaka.html