高感度かつ網羅的な糖鎖解析技術を開発 ~がんの早期診断などへの応用が期待~

【ポイント】
●細胞の「顔」である糖鎖は診断や治療の指標として非常に重要
●新たに開発した二次元分離技術により、微量糖鎖の網羅的な分析を実現
●細胞数が少なく検出が難しいがんの早期診断などへの応用が期待
【概要】
タンパク質のアスパラギン残基に結合する「N結合糖鎖」は重要な翻訳後修飾の一つであり、いわば細胞の「顔」として機能しています。例えば、血液型も細胞表面の糖鎖構造によって決まっています。この糖鎖の種類や量は細胞の状態によって大きく変化するため、診断や治療の標的分子としての利用が期待されています。しかし、早期のがんなどでは細胞数が少ないため、限られた試料に含まれる糖鎖を高感度かつ網羅的に検出する技術が必要です。
既存のN結合糖鎖分析技術として、液体クロマトグラフィー(LC)、キャピラリー電気泳動(CE)、質量分析などが挙げられますが、いずれも分離度や感度のどこかに欠点があり、多種類の糖鎖を完全に分離して高感度に検出することは困難でした。
そこで九州大学大学院理学研究院の川井隆之准教授、松森信明教授、鳥飼浩平助教、劉晨晨助教、三木太陽大学院生(当時)と近畿大学薬学部の山本佐知雄准教授、木下充弘教授らの共同研究グループは、LCとCEという2つの分析法を組み合わせて欠点を補い合った二次元糖鎖分離法を新開発しました。この方法により、今までメジャーな糖鎖の影に隠れて検出できなかったマイナーな微量糖鎖を分離して検出できるようになりました。検出下限は12pM(pM=10-12mol/L)であり、これは角砂糖1個半(約5グラム)を東京ドーム一杯の水(1240万立方メートル)に溶かしてもまだ検出できるレベルの感度です。この方法により、限られた数の細胞からでもマイナーな糖鎖を含む詳細な糖鎖プロファイルを取得できるようになりました。今後、がんの早期診断や治療に向けたバイオマーカー探索などへ広く応用されていくことが期待されます。
本研究成果は、オランダの国際科学誌「Analytica Chimica Acta」に2024年8月7日(水)午前7時(日本時間)に掲載されます。また本研究はAMED-PRIME等の助成を受けたものです。
【研究者からひとこと】
糖鎖はマンノース(●)やNアセチルグルコサミン(■)などの単糖が重合した生体高分子で、様々な組み合わせの複雑な構造が存在します。僅かに構造が違う糖鎖を分離することは非常に難しいのですが、新開発した二次元分離法によって多くの糖鎖を美しく分離できました。似たような構造の糖鎖が綺麗に分かれているのが理解できると思います。世界一の分離能と高感度を併せ持つ次世代糖鎖分析法を開発できたと自負しています。
【研究の背景と経緯】
タンパク質のアスパラギン残基に結合する「N結合糖鎖※1」は重要な翻訳後修飾の一つであり、細胞間の情報伝達・細胞接着・免疫・ウイルス感染などの細胞表面で起きる様々な生命機能に関与しています。N結合糖鎖のプロファイル、つまり試料中のタンパク質にどのような種類の糖鎖がどれくらい修飾されているかは細胞の状態によって大きく変化します。もし特定の病気の時にだけ出現する糖鎖が分かれば、診断や治療の標的分子(バイオマーカー※2)として利用できる可能性があります。実際CA19-9のような糖鎖バイオマーカーががんの診断などに利用されていますが、早期のがん診断には利用できていません。早期のがんでは細胞数が少ないため、限られた試料に含まれる微量糖鎖を高感度かつ網羅的に検出する技術が必要です。
N結合糖鎖を測定するための既存分析技術として、液体クロマトグラフィー(LC※3)、キャピラリー電気泳動(CE※4)、質量分析(MS)などが挙げられます。しかしLCは分離度・感度に、CEは分離度に、MSは感度・定量性にそれぞれ欠点があり、多種類の糖鎖を完全に分離して高感度に検出することは困難でした。そこで本研究ではLCとCEを組み合わせて欠点を補い合わせることを考えました。LCで分離した糖鎖を順番にCEで分けることができれば、1つの方法では分け切れない糖鎖を分離することができます。またCEでは、オンライン試料濃縮法※5と呼ばれる技術を使うことで非常に高感度な糖鎖分析を行うことができます。これらのコンセプトを統合した、高分離能かつ高感度な二次元糖鎖分析法を開発することで、微量の糖鎖を網羅的かつ定量的に解析できるのではないかと考えました。
【研究の内容と成果】
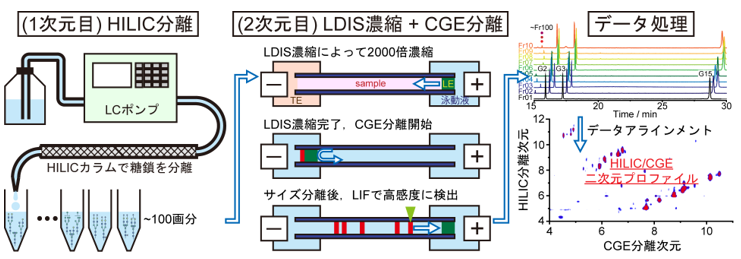
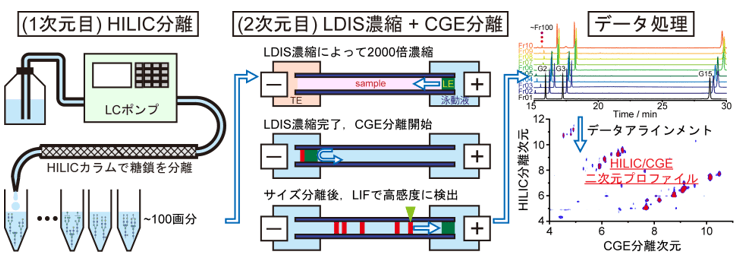
本研究では糖鎖分離に適した分離モードとして、LCでは「親水性相互作用液体クロマトグラフィー(HILIC※6)」、CEでは「キャピラリーゲル電気泳動(CGE※7)」を組み合わせました。通常のHILICでは数µL(µL=100万分の1リットル)程度の試料を分析できるのに対して、CGEでは数nL(nL=10億分の1リットル)程度の試料しか分析できません。つまり、HILICとCGEと組み合わせても、殆どがCGE分析の段階で無駄になってしまい、高感度な分析はできません。そこで私達は、キャピラリー内部で大量の試料を一点に収束させて濃縮する「LDIS※8 」という技術を用いることにしました。LDIS法を用いれば、CGEでもµLレベルの試料を分析できるようになり、試料ロスの少ない高感度な分析を実現できます。他にも内部標準物質を用いたデータ補正や新たな情報処理法を開発することで、最終的にHILIC/CGE二次元分析法を完成させました(図2)。
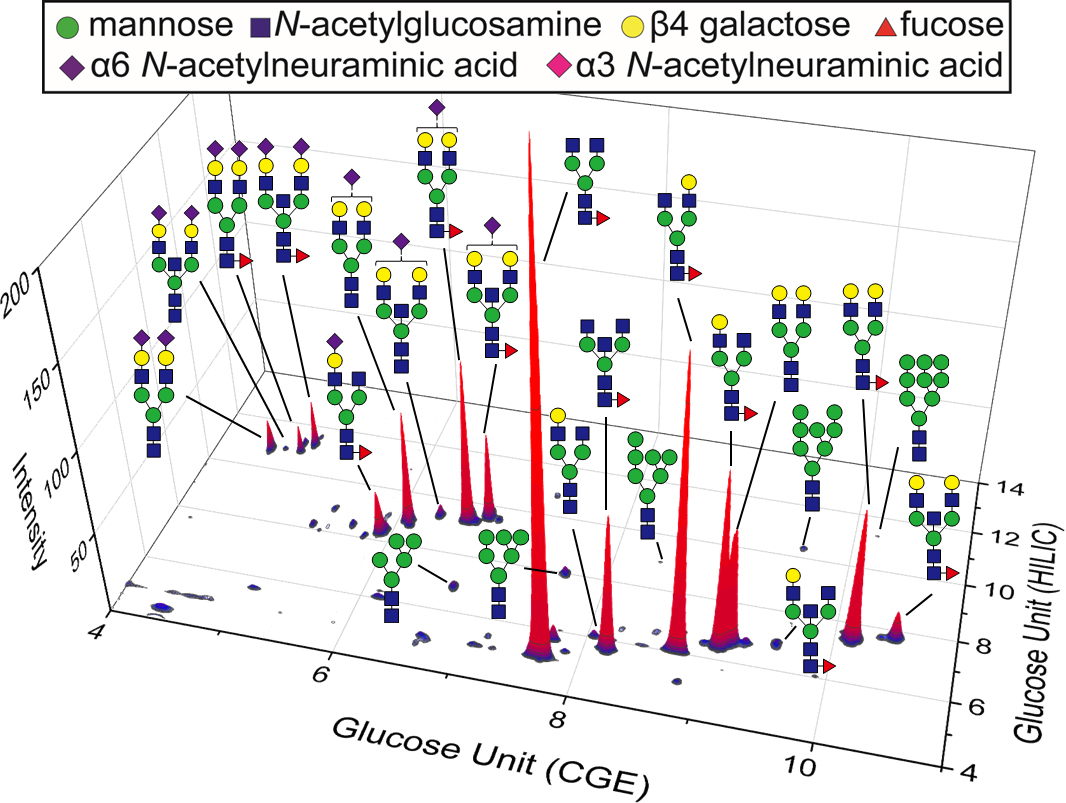
まずモデル糖鎖としてマルトヘプタオースというオリゴ糖を二次元分析したところ、検出限界は12pM(60amol、S/N比=3)に達し、多次元糖鎖分析法として世界最高感度を達成しました。検量線の直線性も良好であり、定量性が高いことも確認できました。続いて糖タンパク質であるヒト由来の免疫グロブリンの糖鎖の解析を行ったところ、通常の分析では20種類程度の糖鎖しか検出できないところ、100程度の糖鎖ピークを検出することに成功し、その内20種類の構造を決定できました(図1)。
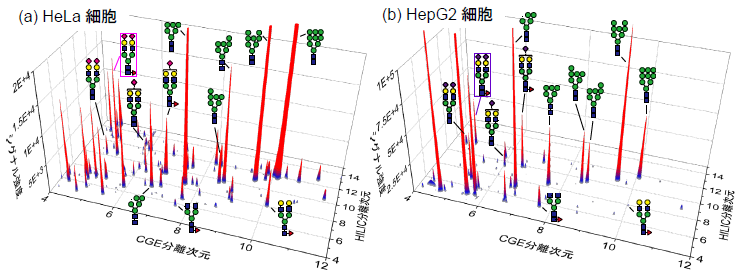
最後に、ヒト子宮頸がん細胞であるHeLa細胞と肝臓がん細胞であるHepG2細胞から得られたN結合糖鎖の二次元解析を行ったところ、非常に多くの糖鎖ピークを分離して検出することに成功しました。がん細胞で増加することが知られているシアル酸結合糖鎖として、HeLa細胞ではα2-3結合シアル酸(ピンクのひし形、ピンク枠の構造など)を含む糖鎖が特異的に検出されたのに対して(図3a)、HepG2細胞ではα2-6結合シアル酸(紫のひし形、紫枠の構造など)を含む糖鎖が特異的に検出され(図3b)、本二次元分析法によってがん細胞の種類による糖鎖の違いを見分けられることが示されました。

【今後の展開】
今回開発した二次元分析法を今後ヒト由来の臨床検体などの解析に応用していくことで、診断や創薬のバイオマーカーなどの発見に繋げていきたいと考えています。一方で、現在一分析につき一日以上の時間を要するため、多くの人に使ってもらえるよう今後は分析速度を向上していく研究開発を進める予定です。また今回は糖鎖に注目した研究を行いましたが、他の生体分子にも応用できる技術なので、メタボローム分析など各種生体分子の網羅解析へ展開していく予定です。
【用語解説】
※1 N結合糖鎖
グルコース(ブドウ糖)などの単糖が鎖状にいくつも結合した生体物質の総称。N結合型糖鎖は、タンパク質のアスパラギン(一文字記号でN)の側鎖に結合している糖鎖を指します。細胞内では、タンパク質の品質管理や輸送の制御に関係することが分かっています。細胞外でもタンパク質の血中内安定性、タンパク質-タンパク質間相互作用、免疫調節、細胞増殖、がんの浸潤など多くの生命現象で重要な役割を果たしていると考えられています。
※2 バイオマーカー
疾患の診断や治療の効果を判定するための生体内の物質や検査項目。例えば糖鎖のバイオマーカーであるCA19-9は、膵臓がんや胆道がんの診断および管理に使用されており、膵臓がん患者の約70-80%で上昇することが確認されています。現在、個別化医療においてバイオマーカーの重要性が増しており、早期疾患の発見・予防の指標として期待されています。
※3 液体クロマトグラフィー(Liquid Chromatography、LC)
混合物を分離するための技術。一般的には、表面を化学的に改変した微粒子を充填したカラム(固定相)に有機溶媒を含む溶液(移動相)を流し続け、この流れの中に試料を注入します。試料に含まれる各化合物で固定相へ吸着する力が異なるため、吸着しにくい化合物から順番にカラムから溶出され、分離されます。
※4 キャピラリー電気泳動(Capillary Electrophoresis、CE)
LC同様に混合物を分離するための技術。一般的には内径50µm(0.050mm)程度の細いガラス管(キャピラリー)に泳動液と呼ばれる水溶液を充填し、ここに試料を注入して数万ボルトの高電圧をかけます。試料に含まれる化合物の中で、水溶液中で電荷を帯びているものは陽極もしくは陰極に引き寄せられますが、この速度が分子のサイズや電荷の大きさによって変化するため、様々な分子を分離することができます。
※5 オンライン試料濃縮法
CEにおいて、キャピラリー内部で電気的に試料の速度をコントロールし、一か所に試料を集めることで濃度を局所的に上げる(濃縮する)方法。電気伝導度、pHなどの変化を利用した方法が開発されており、1000倍以上CEの感度を向上させることが可能な技術として応用が進められています。
※6 親水性相互作用液体クロマトグラフィー(Hydrophilic Interaction Liquid Chromatography、HILIC)」
LCの分離モードの一種。アミドなどで修飾された固定相を用いることで、水酸基やアミノ基などを持つ化合物との親水性相互作用に基づいて分離を行います。糖鎖は親水基やアミドなどの親水性官能基を豊富に持つため、サイズや構造などに基づいて分離することができます。
※7 キャピラリーゲル電気泳動(Capillary Gel Electrophoresis、CGE)
CEの分離モードの一種。泳動液に高分子(ゲル)を添加すると、試料が高分子のネットワークを通過する際に引っ掛かるようになるため、分子サイズや構造の違いによって分離することができます。糖鎖は類似の構造を持つものが多く存在しますが、CGEによって効率的に分離することができます。
※8 LDIS(Large-volume Dual preconcentration by Isotachophoresis and Stacking)
オンライン試料濃縮法の一種。等速電気泳動と電場増強スタッキングという二種類の濃縮法を組み合わせることで、糖鎖を2000倍以上濃縮することができます。
【謝辞】
本研究はJSPS科研費(JP19H02567、JP20K20458、JP21H05092、JP22K18950、JP23H02623)、AMED委託研究課題(JP16ae0101039h0001、JP20gm6410005h9901、JP21ak0101180h0001)、JST委託研究課題(JPMJPR14F9、JPMJMI21G6、JPMJST2281)などの助成を受けたものです。
【論文情報】
掲載誌 :Analytica Chimica Acta
タイトル:Highly Sensitive Two-dimensional Profiling of N-linked Glycans by Hydrophilic Interaction Liquid Chromatography and Dual Stacking Capillary Gel Electrophoresis
著者名 :Takaya Miki, Sachio Yamamoto, Chenchen Liu, Kohei Torikai, Mitsuhiro Kinoshita, Nobuaki Matsumori, Takayuki Kawai
DO I:10.1016/j.aca.2024.342990
【関連リンク】
薬学部 創薬科学科 准教授 山本佐知雄(ヤマモトサチオ)
https://www.kindai.ac.jp/meikan/428-yamamoto-sachio.html
薬学部 創薬科学科 教授 木下充弘(キノシタミツヒロ)
https://www.kindai.ac.jp/meikan/810-kinoshita-mitsuhiro.html