高血圧症の一種「原発性アルドステロン症」の新規原因遺伝子を発見 薬が効かない高血圧症の病態解明に新たな視点

近畿大学医学部(大阪府大阪狭山市)病理学教室主任教授 伊藤 彰彦、富山大学(富山県富山市)先端抗体医薬開発センター副センター長 教授 髙岡 裕、東北大学大学院医学系研究科(宮城県仙台市)特任教授 佐藤 文俊(執筆当時:難治性高血圧・内分泌代謝疾患地域連携寄附講座 教授)、広島大学大学院医系科学研究科(広島県広島市)講師 沖 健司(執筆当時)は、ロンドン大学クイーンメアリー校を中心とする国際的多施設共同研究に参画し、高血圧症の一種である「原発性アルドステロン症」の新しい原因として、接着分子※1 cell adhesion molecule 1(以下、CADM1)の遺伝子変異を同定するとともに、この遺伝子が細胞間のコミュニケーションを支持することで、副腎皮質からの過剰なアルドステロン産生を抑制していることを明らかにしました。本研究成果は、接着分子がホルモン産生に強く関与することを明らかにした点で画期的であり、薬が効かない高血圧症の病態解明に新たな視点をもたらすと期待されます。
本件に関する論文が、令和5年(2023年)6月9日(金)AM0:00(日本時間)に、遺伝学に関する国際的な学術誌"Nature Genetics(ネイチャー ジェネティクス)"にオンライン掲載されました。
【本件のポイント】
●高血圧症の一種である「原発性アルドステロン症」の原因となる、接着分子CADM1の遺伝子変異を発見
●遺伝子変異の結果、副腎皮質細胞の細胞間コミュニケーションを不良にし、副腎皮質細胞におけるアルドステロン産生を増加させることを解明
●本研究成果が、治療抵抗性高血圧症の病態解明に新たな視点をもたらすと期待
【本件の背景】
原発性アルドステロン症は高血圧症の一種で、副腎皮質から分泌されて、血圧の調整を行うアルドステロンというホルモンが過剰になることで、高血圧となります。この症例は、高血圧症全体の約10%、薬が効かない治療抵抗性の高血圧症では約20%を占めると推定されています。通常の高血圧症に比べて、心臓や血管の合併症(脳卒中や不整脈など)を起こしやすいため注意が必要ですが、副腎皮質の病変が小さく、見過ごされるケースが多くあります。
原発性アルドステロン症の原因は、副腎皮質に生じた腫瘍や、過形成※2 となった副腎皮質からのアルドステロンの過剰分泌であり、この過剰分泌の原因となる遺伝子変異がいくつか同定されていますが、依然として原因不明の症例が少なからず残っています。
【本件の内容】
研究グループは、原発性アルドステロン症を引き起こす原因として、アルドステロンを産生する腺腫において、接着分子の役割を果たすCADM1という遺伝子に変異を発見しました。
コンピュータシミュレーションを用いた検証の結果、変異したCADM1によって副腎皮質細胞同士の細胞間距離が広がり、その結果、細胞間コミュニケーションが不良になることが推測されました。さらに、培養細胞を用いた実験では、変異型CADM1が存在する場合は、細胞間コミュニケーションが不良になることが明らかになり、同時に副腎皮質細胞におけるアルドステロン産生を顕著に増加させることもわかりました。また、薬剤を用いて細胞間コミュニケーションを阻害した場合も、アルドステロンの産生が顕著に増加したことから、通常、CADM1は副腎皮質細胞に豊富に存在しており、アルドステロンの過剰な産生・分泌を抑制していると考えられます。
本研究成果は、特に治療抵抗性高血圧症の病態解明に新たな視点をもたらすと期待されます。
【論文概要】
掲載誌:Nature Genetics(インパクトファクター 41.367@2021)
論文名:Somatic CADM1 mutations in aldosterone-producing adenomas and gap junction-dependent regulation of aldosterone production
(アルドステロン産生腺腫におけるCADM1体細胞変異とアルドステロン産生のギャップ結合依存性制御)
著者:Xilin Wu1,2,3、Elena A. B. Azizan1,4,†、Emily Goodchild1,2,3,†、Sumedha Garg1,5,†、萩山 満6,†、Claudia P. Cabrera2,7,†、Fabio L.Fernandes-Rosa8,†、Sheerazed Boulkroun8,†、Jyn Ling Kuan9、Zenia Tiang9、Alessia David10、Masanori Murakami11、Charles A. Mein12、Eva Wozniak12、Wanfeng Zhao13、Alison Marker13、Folma Buss14、Rebecca S. Saleeb15、Jackie Salsbury1,2,3、Yuta Tezuka16、佐藤 文俊16,17、沖 健司18、Aaron M. Udager19、Debbie L. Cohen20、Heather Wachtel21、Peter J. King22、William M. Drake2,3、Mark Gurnell23、Jiri Ceral24、Ales Ryska25、Muaatamarulain Mustangin26、Yin Ping Wong26、Geok Chin Tan26、Miroslav Solar24、Martin Reincke11、William E. Rainey27、Roger S. Foo9、高岡 裕28、Sandra A. Murray29,††、Maria-Christina Zennaro8,30,††、Felix Beuschlein31,††、伊藤 彰彦6,††、Morris J. Brown1,2,††
*責任著者、†責任著者と同等貢献、††共同統括
所属:1 ロンドン大学クイーン・メアリー校ウイリアム・ハーベー研究所臨床薬理部門、2 ロンドン大学クイーン・メアリー校ロンドン医科歯科学部、3 聖バーソロミュー病院、4 マレーシア国民大学医学部薬学部門、5 ケンブリッジ大学臨床薬理学ユニット、6 近畿大学医学部病理学教室、7 ロンドン大学クイーン・メアリー校ウイリアム・ハーベー研究所トランスレーショナル生物情報センター、8 パリ・シテ大学パリ心臓血管リサーチセンター、9 シンガポール国立大学医学部、10 インペリアルカレッジロンドン ライフサイエンス学科、11 ルートヴィヒ・マクシミリアン大学ミュンヘン、12 ロンドン大学クイーン・メアリー校ブリザード研究所、13 アデンブルックス病院、14 ケンブリッジ大学CIMR、15 ロンドン大学クイーン・メアリー校ウイリアム・ハーベー研究所 細小血管リサーチセンター、16 東北大学病院腎臓・高血圧内科、17 東北大学大学院医学系研究科、18 広島大学大学院医系科学研究科、19 ミシガン大学医学大学院、20 ペンシルベニア大学ペレルマン医学部、21 ペンシルベニア大学病院、22 ロンドン大学クイーン・メアリー校ウイリアム・ハーベー研究所内分泌学部門、23 ケンブリッジ大学ケンブリッジ生物医学研究所、24 カレル大学医学部第一内科学部門、25 カレル大学医学部病理学部門、26 マレーシア国民大学医学部病理学部門、27 ミシガン大学代謝・内分泌・糖尿病部門、28 富山大学先端抗体医薬開発センター、29 ピッツバーグ大学医学部、30 ジョルジュ・ポンピドゥー欧州病院、31 チューリッヒ大学病院
【本件の詳細】
CADM1は、免疫グロブリンスーパーファミリー※3 に属する、細胞膜1回貫通型の細胞膜タンパク質で、細胞同士を結び付ける接着分子として機能しています。内分泌細胞や神経に存在することが知られており、なかでも副腎皮質細胞に豊富に発現しています。今回の研究で、アルドステロン産生腺腫※4 においても豊富な発現が確認されました。先行研究での遺伝子解析により、アルドステロン産生腺腫ではイオンチャネルやトランスポーター遺伝子に機能獲得性変異※5 が高頻度に見出されています。
今回の共同研究では、イギリスのケンブリッジ大の40例、ドイツの80例、フランスの34例のヒトのアルドステロン産生腺腫について全エクソン解析※6 を実施、アメリカの204例についてCADM1遺伝子に限ったゲノム解析を実施し、そのうち6例においてCADM1に1塩基が置換されるタイプの遺伝子変異が見つかりました。イギリスのロンドン大17例と、日本の24例では変異は見出されませんでした。ここから、CADM1変異の発生頻度は0.5~1.0%と予想されます。
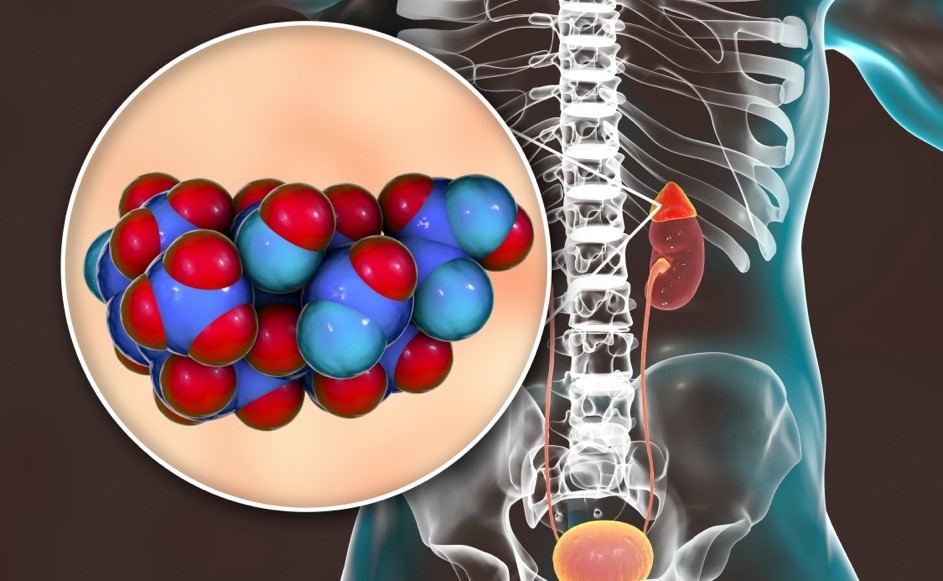
今回発見した遺伝子変異は、CADM1が細胞膜を貫通する領域内の2つのアミノ酸残基にのみ確認されました。さらに、そのアミノ酸残基は隣り合っており、遺伝子変異の結果、腺腫では1アミノ酸置換(G379DまたはV380D)を持つ変異型CADM1※7 が発現していると考えられました。この2種類の変異型CADM1について、分子構造をコンピュータシミュレーションにより調べた結果、細胞膜貫通領域の長さが正常型より短くなり、その影響で正常型CADM1が細胞膜に対して49度の傾きで貫通しているのに対して、変異型CADM1は細胞膜に対して傾き62度、あるいは90度で貫通すると推測されました(図)。貫通角度が広くなることで、細胞膜間の距離が広がり、結果的に細胞間コミュニケーションが不良になると考えられます。細胞間距離拡大の予測値は3.5~6.7nmとごくわずかですが、隣り合う細胞間のコミュニケーションを司るコネキシン※8 という分子同士の結合を乖離させるには十分と予想されます(図)。実際に、細胞培養実験で副腎皮質細胞に変異型CADM1を発現させ、dye transferアッセイ※9 により確認したところ、細胞間コミュニケーション能が有意に低下していることが確認できました。
また、変異型CADM1を発現させた副腎皮質細胞では、アルドステロンの産生が顕著に増加していたことから、細胞間コミュニケーションが不良になるとアルドステロンが過剰に産生されると考えられました。そこで、コネキシンの結合を阻害するペプチド(Gap27※10)を副腎皮質細胞の培養系に添加し、細胞間コミュニケーションを不良にしました。その結果、コネキシンの結合を阻害することで、変異型CADM1と同様に、副腎皮質細胞におけるアルドステロン産生を顕著に増加させることが明らかになりました。ここから、変異型CADM1は、アルドステロン産生腺腫における過剰なアルドステロン産生の原因と示唆されました。一方、正常型CADM1は、副腎皮質細胞同士間のコミュニケーションを良好に保つことで、過剰なアルドステロン産生が生じないように機能していると考えられました。
細胞膜タンパク質である接着分子は、互いに結合して細胞同士を結び付けるという単純な役割と考えられていますが、結合に特化しているがゆえに、細胞膜貫通角度が13度増すといった細胞膜上での存在様態のわずかな変化だけで、細胞の機能に深刻な病的状態を生じさせる可能性があるとわかりました。これは、高血圧症や内分泌の研究領域において今までにない斬新な視点であり、今後、病態解明や生理機能解析において、画期的な知見がもたらされると期待されます。

【研究代表者コメント】
伊藤 彰彦(いとう あきひこ)
所属 :近畿大学医学部病理学教室
職位 :主任教授/近畿大学大学院医学研究科長
学位 :博士(医学)
コメント:細胞間接着分子は、その名前から細胞同士を結び付ける"糊(のり)"のようなものだと思われがちですが、詳細に見てみると、細胞と細胞の間に適切な隙間を作るという側面もあることに気が付きます。今回の研究では、接着分子に異常が生じると、細胞間の隙間が広がるような事態が生じることを見出しました。隙間の拡大がわずかであっても、それが副腎皮質細胞に生じるとアルドステロンというホルモンを過剰に産生することとなり、高血圧症(原発性アルドステロン症)を引き起こすことがわかりました。今の内服薬が効かない高血圧症の一部は、この機序で説明される可能性があります。接着分子異常に着目した研究アプローチが、高血圧症の新たな診断法・治療薬開発や腫瘍発生メカニズム解明に繋がることを期待しています。
【用語解説】
※1 接着分子:細胞膜表面に存在するタンパク質で、隣り合う細胞間で同種、または異種のタンパク質と強く結合する特有の構造を有する。このタンパク質同士の結合により、隣接する細胞間の距離や物理的な強度が適切に維持される。一般的な細胞間距離は、20~25nm。(1nmは1mmの100万分の1)
※2 過形成:外的な要因で、細胞が正常な形態や配置を保ったまま過剰に増殖し、組織や器官が大きくなること。
※3 免疫グロブリンスーパーファミリー:免疫グロブリン(タンパク質)が持つループ構造と、類似の構造を細胞外領域に持つ細胞膜タンパク質の一群。このファミリーには、CADM1と同じように接着分子として機能するものが多く含まれる。
※4 アルドステロン産生腺腫:アルドステロンを自律性に産生する良性腫瘍。副腎皮質に発生し、腫瘍細胞は副腎皮質細胞に類似している。
※5 機能獲得性変異:遺伝子から翻訳されたタンパク質が持つ、本来の機能が亢進する方向に変化する遺伝子変異
※6 全エクソン解析:細胞や組織からゲノムを抽出した後、ゲノム上のタンパク質をコードするエクソン領域(エクソーム)を選択的にキャプチャーして、その塩基配列を決定する解析。
※7 1アミノ酸置換(G379DまたはV380D)を持つ変異型CADM1:正常なCADM1(タンパク質)のアミノ酸残基は、N末端から379番目がグリシン(G)で380番目がバリン(V)。アルドステロン産生腺腫では、379番目のアミノ酸残基がアスパラギン酸(D)に変化したものと、380番目のアミノ酸残基がアスパラギン酸(D)に変化したものの2種類(変異型CADM1)が見つかった。
※8 コネキシン:細胞膜を貫通するタンパク質で、6分子が会合して導管状構造(コネクソンと呼ばれる)を作る。隣り合う細胞間でコネクソンがドッキングする(ギャップ結合と呼ばれる)と、細胞内のイオンや小分子が導管を通じて隣の細胞に移動できる。これが細胞間コミュニケーションの本体と見なされている。コネクソン同士には結合力がないので、ギャップ結合形成には適切な接着分子が近傍に必要である。
※9 dye transferアッセイ:ギャップ結合を介してのみ細胞間を移動できる色素(dye)を用いて細胞間コミュニケーション能を評価するアッセイ法。培養系で細胞を敷き詰めた後、色素を一細胞にのみ付与し、その後の時間経過で色素が何個の細胞にまで広がって行ったかを調べる。
※10 Gap27:コネキシンの細胞外領域に相同性を有するペプチドで、コネクソン同士の結合(=ギャップ結合形成)を阻害する。アミノ酸配列はSer-Arg-Pro-Thr-Glu-Lys-Thr-Ile-Phe-Ile-Ile。
【関連リンク】
医学部 医学科 教授 伊藤 彰彦(イトウ アキヒコ)
https://www.kindai.ac.jp/meikan/825-itou-akihiko.html
医学部 医学科 講師 萩山 満(ハギヤマ ミツル)
https://www.kindai.ac.jp/meikan/1764-hagiyama-mitsuru.html