電子版臨床試験同意書業界ランキング2026:売上、シェア、企業規模による分析
LP Information最新市場レポート「世界電子版臨床試験同意書市場の成長予測2026~2032」
電子版臨床試験同意書(eConsent in Clinical Trials)は、被験者が臨床試験への参加に際して行う同意手続きを、デジタルプラットフォーム上で安全かつ透明に実施する仕組みである。従来の紙ベースの署名や対面説明を、電子署名、映像説明、インタラクティブな理解確認機能などによって代替・補完し、臨床試験の透明性、遵守性、効率性を大幅に高める。医薬品開発における倫理的説明責任とデータ管理の高度化が求められる中で、eConsentは治験の品質向上、手続きの簡素化、そして患者中心の医療実現を支える重要な要素技術となっている。また、電子署名法やGxP準拠のデジタル認証技術が整備されつつあることにより、国際的にもその信頼性と法的効力が確立されつつある。臨床試験の分散化が加速する現在、eConsentは治験プロセスの根幹をデジタル化する中核インフラとして位置付けられる。
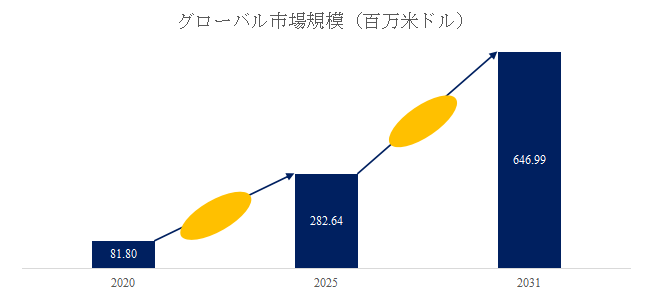
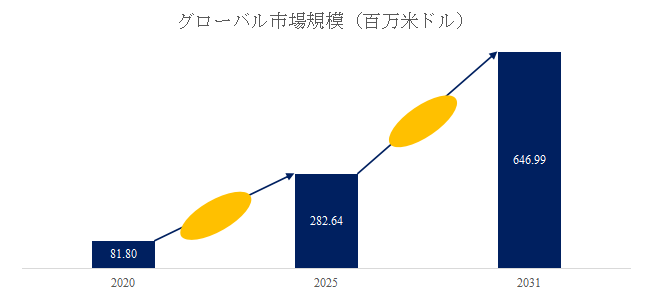
急速な市場拡大と需要構造の変化
LP Information調査チームの最新レポートである「世界電子版臨床試験同意書市場の成長予測2026~2032」によると、2025年から2031年の予測期間中のCAGRが14.8%で、2031年までにグローバル電子版臨床試験同意書市場規模は6.47億米ドルに達すると予測されている。この急伸の背景には、臨床試験のデジタル化・分散化(DCT: Decentralized Clinical Trials)の潮流と、遠隔同意・リモートモニタリングを可能にするIT基盤の整備がある。製薬企業・CRO(開発業務受託機関)は、試験実施のスピードと被験者エンゲージメントの両立を図る上で、eConsentの導入を標準化しつつある。特にコロナ禍以降、非対面型の治験運営モデルが一気に普及し、電子署名・ビデオ説明・クラウドデータ連携を一体化したソリューションの需要が拡大した。こうした変化は一過性ではなく、製薬産業全体のデジタルトランスフォーメーションを加速させる長期的な構造転換として定着している。
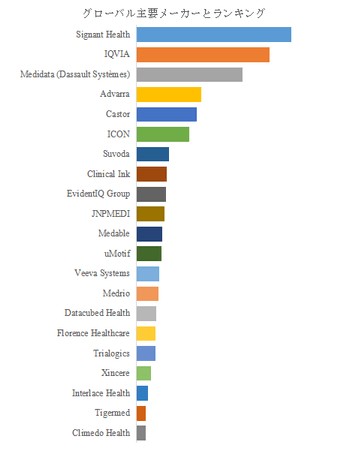
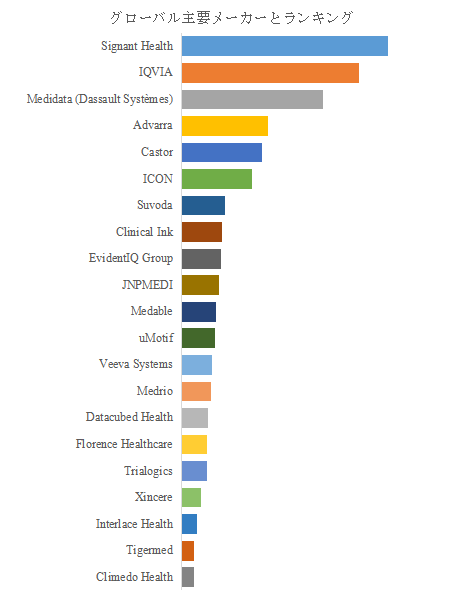
競争環境と技術的進化の方向性
LP Informationのトップ企業研究センターによると、電子版臨床試験同意書の世界的な主要製造業者には、Signant Health、IQVIA、Medidata (Dassault Systèmes)、Advarra、Castor、ICON、Clinical Ink、Suvoda、EvidentIQ Group、JNPMEDIなどが含まれている。2024年、世界のトップ10企業は売上の観点から約52.0%の市場シェアを持っていた。
Signant Healthは被験者エクスペリエンス設計とデータ統合力に強みを持ち、IQVIAは広範な治験データ基盤とAI解析技術を融合した統合型eConsentソリューションを展開している。Medidataはクラウドベースの臨床試験管理システム(CTMS)とシームレスに連携し、被験者・治験責任医師・製薬企業を一体化するエコシステムを形成している。一方、uMotifやMedableのような新興企業は、モバイルアプリを中心とした直感的UI設計と患者主導型インターフェースに注力しており、被験者理解度の向上と離脱率低減に寄与している。近年は、電子署名のセキュリティ強化、AIによる同意内容理解度の自動評価、ブロックチェーン技術を用いた改ざん防止機構など、技術的進化が市場競争の焦点となっている。さらに、複数言語対応・動画解説の標準化が進み、国際共同治験の実施効率が飛躍的に向上している。
日本市場と今後の展望
日本市場では、製薬企業・医療機関・CRO間でのデジタル連携が段階的に進展しており、eConsent導入は治験効率化の主要テーマとなっている。特に、被験者の高齢化と遠隔地参加の増加を背景に、非対面同意プロセスの必要性が急速に高まっている。国内でも医薬品医療機器総合機構(PMDA)による電子データ活用の指針が整備され、eConsentの法的・倫理的運用基盤が整いつつある。さらに、医療機関における電子カルテやEDC(Electronic Data Capture)とのデータ連携により、同意内容の一元管理と再利用が可能となり、治験運営の透明性とコンプライアンスが向上している。製薬産業の競争力を左右する要素が「スピード」と「信頼性」へと移行する中で、eConsentは単なるデジタル文書ツールではなく、治験の品質管理と被験者保護を両立する戦略的インフラへと進化している。今後は、AI翻訳や自動理解確認機能を組み合わせた多言語対応の高度化、ならびに患者エンゲージメントを可視化するプラットフォーム統合が進むことで、国内外の治験オペレーションの効率化と国際競争力の向上に寄与することが期待される。
【 電子版臨床試験同意書 報告書の章の要約:全14章】
第1章では、電子版臨床試験同意書レポートの範囲を紹介するために、製品の定義、統計年、調査目的と方法、調査プロセスとデータソース、経済指標、政策要因の影響を含まれています
第2章では、電子版臨床試験同意書の世界市場規模を詳細に調査し、製品の分類と用途の規模、販売量、収益、価格、市場シェア、その他の主要指標を含まれています
第3章では、電子版臨床試験同意書の世界市場における主要な競争動向に焦点を当て、主要企業の売上高、収益、市場シェア、価格戦略、製品タイプと地域分布、産業の集中度、新規参入、M&A、生産能力拡大などを紹介します
第4章では、電子版臨床試験同意書の世界市場規模を、主要地域における数量、収益、成長率の観点から分析します
第5章では、アメリカ地域における電子版臨床試験同意書業界規模と各用途分野について、販売量と収益に関する詳細情報を探します
第6章では、アジア太平洋地域における電子版臨床試験同意書市場規模と各種用途を、販売量と収益を中心に分析します
第7章では、ヨーロッパ地域における電子版臨床試験同意書の産業規模と特定の用途について、販売量と収益について詳しく分析します
第8章では、中東・アフリカ地域における電子版臨床試験同意書産業の規模と様々な用途、販売量と収益について詳しく考察します
第9章では、電子版臨床試験同意書の業界動向、ドライバー、課題、リスクを分析します
第10章では、電子版臨床試験同意書に使用される原材料、サプライヤー、生産コスト、製造プロセス、関連サプライチェーンを調査します
第11章では、電子版臨床試験同意書産業の販売チャネル、流通業者、川下顧客を研究します
第12章では、電子版臨床試験同意書の世界市場規模を地域と製品タイプ別の売上高、収益、その他の関連指標で予測します
第13章では、電子版臨床試験同意書市場の主要メーカーについて、基本情報、製品仕様と用途、販売量、収益、価格設定、粗利益率、主力事業、最近の動向などの詳細情報を紹介します
第14章では、調査結果と結論
【レポートの詳細を確認する、または無料サンプルを申し込む】
https://www.lpinformation.jp/reports/593701/econsent-in-clinical-trials
会社概要
LP Informationは、業界情報と市場戦略サポートを提供する世界有数のプロバイダーです。包括的な市場動向分析レポートや最新のグローバル業界トレンドの概要を提供し、戦略立案や公式情報報告に役立つ効果的なサポートを行っています。
お問い合わせ先
日本語サイト:https://www.lpinformation.jp/
英語サイト:https://www.lpinformationdata.com/
電子メールアドレス:info@lpinformationdata.com