筋萎縮性側索硬化症と前頭側頭型認知症の新たな治療標的の提案へ タンパク質が異常に凝集するメカニズムを解明

近畿大学医学部(大阪府大阪狭山市)内科学教室(脳神経内科部門)主任教授 永井義隆、近畿大学ライフサイエンス研究所講師 武内敏秀らの研究グループは、京都府立医科大学(京都府京都市)研修員(脳神経内科学)上田哲大、同大学院医学研究科脳神経内科学特任教授 水野敏樹らとの共同研究で、神経難病である筋萎縮性側索硬化症(ALS)と前頭側頭型認知症(FTD)の原因となるタンパク質TDP-43※1 の異常凝集が、細胞内の物質輸送の障害により引き起こされることを明らかにしました。さらに、細胞内の物質輸送の障害がALSやFTDを悪化させることを、疾患モデル動物を用いて証明しました。本研究により、細胞内の物質輸送を標的とした新たな治療法の開発が期待されます。
本件に関する論文が、令和6年(2024年)2月5日(月)に、神経病理学領域の国際的な学術誌"Acta Neuropathologica Communications(アクタ ニューロパソロジカ コミュニケーションズ)"にオンライン掲載されました。
【本件のポイント】
●筋萎縮性側索硬化症(ALS)と前頭側頭型認知症(FTD)において、細胞内の物質輸送の障害が、タンパク質TDP-43の異常凝集を引き起こすことを発見
●細胞内の物質輸送の障害が、TDP-43の異常凝集を介してALSやFTDを悪化させることを、疾患モデルショウジョウバエを用いて証明
●ALSやFTDに対し、細胞内輸送を標的とした新たな治療法開発につながる研究成果
【本件の背景】
筋萎縮性側索硬化症(ALS)は、全身の筋肉が急速に衰えていく神経疾患です。また、前頭側頭型認知症(FTD)は、アルツハイマー型認知症やレビー小体型認知症の次に多い、変性性認知症※2 です。これらの神経難病は、まだ原因が十分に解明されておらず、根本的な治療法も開発されていません。
近年、ほぼすべてのALS患者と半数程度のFTD患者において、TDP-43というタンパク質が神経細胞内で異常に凝集・蓄積することが明らかとなりました。そのため、TDP-43が神経細胞内で異常凝集・蓄積することが、ALSやFTDを引き起こすのではないかと考えられています。しかし、TDP-43がどのようにして異常凝集・蓄積するのかは、ほとんど分かっていません。
【本件の内容】
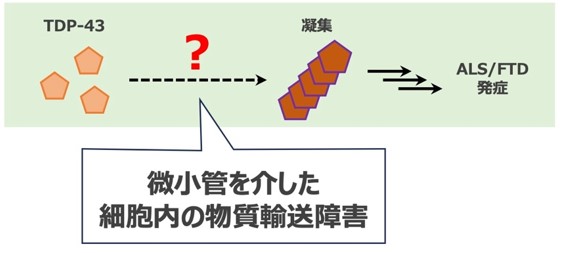
研究グループは、TDP-43の異常凝集や蓄積のメカニズムを明らかにすることが、ALSやFTDの治療法開発への道を拓くと考え、疾患モデル細胞とモデルショウジョウバエを用いて実験を行いました。その結果、細胞内の物質輸送に重要な働きをする微小管※3 モータータンパク質※4 の機能が低下すると、TDP-43の細胞内挙動が異常となって、ALSとFTD患者で見られるようなTDP-43の異常凝集が引き起こされ、神経変性が悪化することが分かりました。
本研究によって、細胞内の物質輸送の障害がTDP-43の異常凝集を引き起こす可能性が初めて明らかとなりました。これにより、今後、ALSやFTDに対し、細胞内の物質輸送、特に微小管を介した輸送を標的とした新たな治療法の開発が期待されます。


【論文概要】
掲載誌:
Acta Neuropathologica Communications(インパクトファクター:7.1@2022)
論文名:
Dysregulation of stress granule dynamics by DCTN1 deficiency exacerbates TDP-43 pathology in Drosophila models of ALS/FTD
(DCTN1の障害はストレス顆粒動態の異常を引き起こし、ALS/FTDショウジョウバエモデルにおけるTDP-43凝集を促進させる)
著者 :
上田哲大1,3,5*注、武内敏秀2,3*※、藤掛伸宏6、鈴木マリ3,6、皆川栄子7、上山盛夫1,3,6、藤野雄三1,5、木村展之8、長野清一3,4、横関明男9、小野寺理9、望月秀樹4、水野敏樹5、和田圭司6、永井義隆1,2,3,4,6 ※ *共同筆頭著者 ※ 責任著者
所属 :
1 近畿大学医学部内科学教室(脳神経内科部門)、2 近畿大学ライフサイエンス研究所、3 大阪大学大学院医学系研究科神経難病認知症探索治療学、4 同神経内科学、5 京都府立医科大学大学院医学研究科脳神経内科学、6 国立精神・神経医療研究センター神経研究所疾病研究第四部、7 同モデル動物開発研究部、8 岡山理科大学獣医学部獣医保健看護学科、9 新潟大学脳研究所脳神経内科
注)京都府立医科大学大学院医学研究科大学院生在学中に近畿大学医学部へ特別研究派遣学生として派遣
【研究詳細】
ALSやFTDにおいて、TDP-43というタンパク質が神経細胞で異常に凝集して蓄積することが、病気の発症や進行に深く関与すると考えられています。しかし、このタンパク質がどのようにして凝集・蓄積するのかは現在、よく分かっていません。興味深いことに、ペリー症候群※5 という別の神経難病でも、TDP-43が異常凝集・蓄積することが報告されています。ペリー症候群は、微小管モータータンパク質の構成因子であるDCTN1※6 というタンパク質の遺伝子変異が原因で発症します。つまり、微小管モータータンパク質の異常が、TDP-43の凝集・蓄積を引き起こすきっかけになっているのではないか、と考えられます。
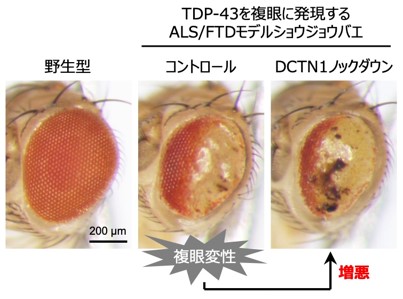
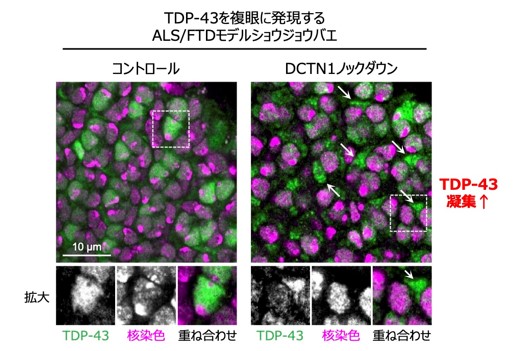
研究グループは、ALS/FTDモデルショウジョウバエと培養細胞モデルを用いて、この仮説を検証しました。その結果、疾患モデルショウジョウバエにおいて、DCTN1遺伝子をノックダウン※7 すると、ALS/FTD患者で見られるようなTDP-43の異常凝集が引き起こされ、神経変性が悪化することが分かりました(図2、図3)。また、培養細胞においてDCTN1遺伝子をノックダウンすると、TDP-43の細胞内挙動が異常となり、TDP-43が細胞質内に異常凝集・蓄積することが明らかとなりました。さらに、ALS/FTDモデルショウジョウバエにおいて、DCTN1だけでなく、微小管モータータンパク質の他の構成因子をノックダウンした場合でも、同様にTDP-43の異常凝集が引き起こされ、神経変性が悪化することが分かりました。この結果は、単にDCTN1タンパク質の異常というよりも、むしろ微小管モータータンパク質の機能異常、すなわち細胞内の物質輸送の障害が、TDP-43の異常凝集を引き起こすきっかけとなっていることを示唆しています。
本研究により、細胞内の物質輸送の障害が、TDP-43の異常凝集を引き起こすという可能性が初めて明らかとなりました。一部のALS患者では、早期から運動神経でDCTN1遺伝子の発現低下が報告されていますが、今回明らかとなったモータータンパク質の機能異常や細胞内物質輸送の障害が、広くALSやFTDの発症や進行に関与するのかについては、今後検証していく必要があります。また、細胞内の輸送障害が、どのようにしてTDP-43の凝集を引き起こすのかについて、まだまだ不明な点が多く、さらなる詳細な解析が必要です。
本研究は、TDP-43が異常に凝集する新しいメカニズムを提唱するものであり、今後、ALSやFTDに対し、細胞内の物質輸送、特に微小管を介した輸送を標的とした新たな治療法の開発が期待されます。
【研究代表者のコメント】
永井義隆(ながいよしたか)
所属 :近畿大学医学部内科学教室(脳神経内科部門)
職位 :主任教授
学位 :博士(医学)
コメント:ALSやFTDだけでなく、アルツハイマー病やパーキンソン病などの神経変性疾患において、さまざまな原因タンパク質が明らかになっています。最近、これらの原因タンパク質を標的とした医薬品の研究が進んでいますが、さらなる治療開発のためにはタンパク質が異常凝集を引き起こすメカニズムを詳細に解き明かす必要があります。今回の研究は、ほとんどのALS患者と半数程度のFTD患者の原因となるTDP-43凝集のメカニズムを解明し、新たな治療戦略を展開するうえで重要な発見になると期待しています。
【研究支援】
本研究は、JSPS科学研究費助成事業学術変革領域研究(A)(20H05927)および同基盤研究(B)(21H02840、22H02792)の一環として行われました。
【用語説明】
※1 TDP-43:RNAやDNAに結合するタンパク質。通常は主に細胞の核内に存在する。ほぼすべてのALS患者と半数程度のFTD患者において、細胞質内で異常な凝集・蓄積が認められる。
※2 変性性認知症:神経細胞の機能障害や細胞死により引き起こされる認知症。
※3 微小管:細胞の構造を支える細胞骨格の一つ。細胞内には微小管上を移動する物質輸送システムが存在する。
※4 モータータンパク質:細胞内の物質を輸送するタンパク質。微小管上を移動するモータータンパク質として、ダイニンやキネシンが知られている。
※5 ペリー症候群:遺伝性の神経難病の一つ。パーキンソン病のような動作異常や歩行・姿勢異常などの症状が起こる。DCTN1遺伝子の変異が原因として同定されている。
※6 DCTN1:微小管モータータンパク質であるダイニンと協調して働くダイナクチンの構成因子。
※7 ノックダウン:遺伝子の発現を抑制すること。
【関連リンク】
医学部 医学科 教授 永井義隆(ナガイヨシタカ)
https://www.kindai.ac.jp/meikan/2687-nagai-yoshitaka.html
医学部
https://www.kindai.ac.jp/medicine/
近畿大学ライフサイエンス研究所
https://www.med.kindai.ac.jp/life/