小児下痢症を引き起こすウイルスの感染に重要な因子を同定 ウイルスの感染予防や治療法開発に役立つ研究成果

近畿大学生物理工学部(和歌山県紀の川市)遺伝子工学科教授 中西章、北里大学大村智記念研究所・大学院感染制御科学府(東京都港区)教授 片山和彦、同准教授 芳賀慧、同助教 戸高玲子、国立感染症研究所病原体ゲノム解析研究センター(東京都武蔵村山市)主任研究官 横山勝、国立研究開発法人国立長寿医療研究センター(愛知県大府市)研究補助員 加藤晶子(執筆当時)の研究グループは、小児下痢症を引き起こすヒトアストロウイルスの感染受容体※1を世界ではじめて同定しました。これまでは実験でヒトアストロウイルスを安定して感染させることが難しく、感染機構の解明が進んでいませんでしたが、本研究成果により、ヒトアストロウイルスの感染予防法や治療法の開発が進むと期待されます。
本件に関する論文が、令和6年(2024年)9月13日(金)に、国際的な科学雑誌"Genes to Cells(ジーンズ トゥー セルズ)"に掲載されました。
【本件のポイント】
●小児下痢症を引き起こすヒトアストロウイルスが、ヒトの細胞へ侵入する際に利用する感染受容体を同定
●ヒトアストロウイルスの実験系を整え、これまでできなかったウイルス感染の過程で必要な細胞遺伝子を網羅的に解析
●ヒトアストロウイルスの感染機構の解明と、感染予防法や治療法開発につながる研究成果
【研究の背景】
アストロウイルスは、特に小児の嘔吐下痢症を引き起こすウイルスで、乳幼児の急性胃腸炎からの検出率は、ロタウイルス、ノロウイルスに次いで高頻度であり、世界各国に広く分布しています。ヒトに感染するアストロウイルスは全部で4種類あり、古典的アストロウイルス1種類と、新型アストロウイルス3種類が知られています。このうち、小児下痢症は主に古典的ヒトアストロウイルスが原因で発症しますが、感染増殖機構の解明が進んでおらず、未だに不明な点が多いのが現状です。
一般的に、ウイルスの感染機構を解明する手法として、ウイルスに感受性のある培養細胞に対してランダムに遺伝子変異を導入し、それらをウイルスに感染させ、その中で生き残った細胞の遺伝子を調べることで、感染過程で必要な「感染受容体」を同定する方法が知られています。しかし、古典的ヒトアストロウイルスは効率的に細胞に感染させることが難しく、また、感染しても生き残る細胞もあり、感染した状況を再現しにくいという問題があります。ウイルスの感染予防法や治療法の開発のために、ヒト感染症を引き起こすウイルスの感染受容体の同定、そしてそのために必要な実験的手法の確立が強く求められています。
【本件の内容】
研究グループは、古典的ヒトアストロウイルスに対する感受性が高い株を培養細胞の中から選別し、その株を用いて全てのヒト遺伝子を個々にノックアウト※2した細胞ライブラリー※3を作成しました。そこにウイルスを感染させ、確実に感染した細胞が死滅する条件を利用して、耐性をもつ細胞のスクリーニングを複数回行いました。その結果、「胎児性Fc受容体」の遺伝子をノックアウトした場合に、古典的ヒトアストロウイルスの感染に耐性を持つことがわかりました。
胎児性Fc受容体は、血漿中から細胞内に取り込まれたIgG抗体※4を分解から守り、再び血漿中に送り出す機能を持つ受容体で、2つのサブユニット※5から形成されています。このサブユニットを一つずつノックアウトした場合でも、古典的ヒトアストロウイルスへの感染耐性が付与できることもわかりました。また、元々胎児性Fc受容体の発現がほぼなく、古典的ヒトアストロウイルスに感受性がなかった細胞に対して、2つのサブユニットの遺伝子を新たに導入することで、ウイルスへの感受性を付与できることも明らかにしました。これらの結果から、胎児性Fc受容体は古典的ヒトアストロウイルスの感染受容体であることを示しました。
本研究成果により、小児下痢症を引き起こす古典的ヒトアストロウイルスの受容体が胎児性Fc受容体であることが明らかになり、今後さらに研究を進めることで、ヒトアストロウイルス感染症に対する予防・治療法の開発につながることが期待されます。
【論文掲載】
掲載誌:Genes to Cells(インパクトファクター:2.1@2022)
論文名:Neonatal Fc receptor is a functional receptor for classical human astrovirus.
(胎児性Fc受容体は古典的ヒトアストロウイルスの機能的な受容体である)
著者 :芳賀慧1、徳井峻1、宮本華奈1、戸高玲子1、工藤栞1、石川梓1、石山涼翔1、
加藤晶子2、横山勝3、片山和彦1*、中西章2、4* *責任著者
所属 :1 北里大学大村智記念研究所・大学院感染制御科学府、2 国立長寿医療研究センター、
3 国立感染症研究所病原体ゲノム解析研究センター、4 近畿大学生物理工学部
URL :http://doi.org/10.1111/gtc.13160
DOI :10.1111/gtc.13160
【研究の詳細】
ヒトアストロウイルスは全部で4種類あり、古典的アストロウイルスとよばれて8つの血清型に分けられるMamastrovirus1と、新型アストロウイルスとよばれるMamastrovirus6(MBL1,2)、Mamastrovirus8(VA2,4,5)、Mamastrovirus9(VA1,3)が知られています。このうち、小児下痢症を引き起こすヒトアストロウイルスの感染受容体は未同定でした。研究グループは、古典的アストロウイルスが安定して感染増殖する実験系を整え、CRISPR-Cas9※6による遺伝子ノックアウトを用いたスクリーニングによって、古典的ヒトアストロウイルスの感染受容体の同定を行いました。
(1)ゲノムワイドの遺伝子ノックアウトスクリーンによる胎児性Fc受容体遺伝子の検出
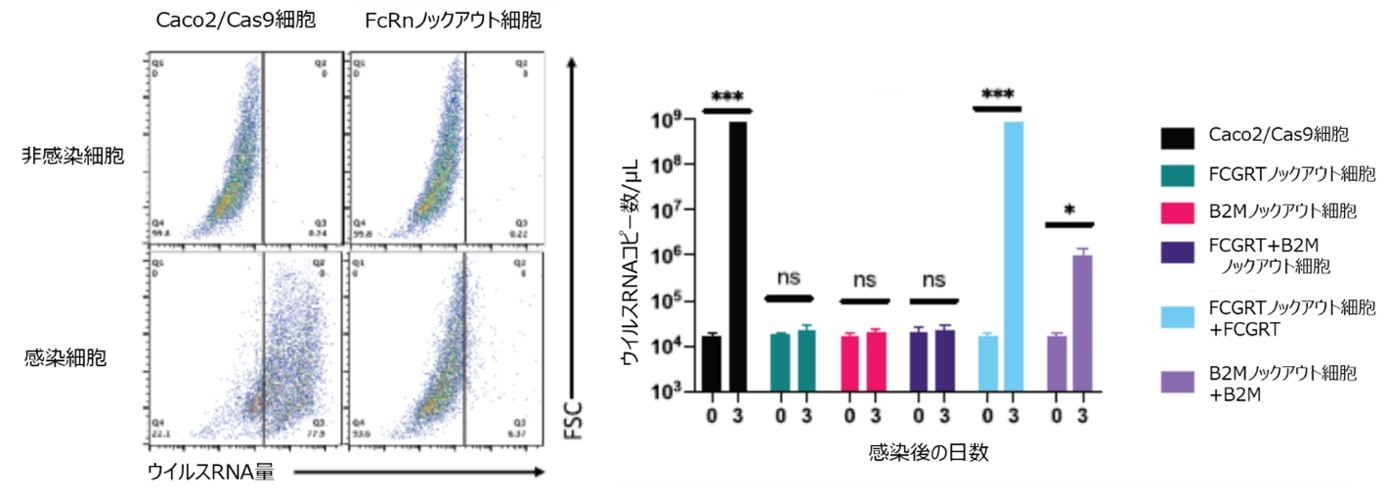
古典的ヒトアストロウイルスに対する感受性が高いCaco2細胞株を用い、CRISPR-Cas9によるゲノム編集を利用して、ヒトゲノムにコードされる全ての遺伝子に対してノックアウト変異を導入した細胞ライブラリーを作成しました。まず、Cas9を恒常的に発現するCaco2細胞を作成し、約1.9万の遺伝子を標的にした約12.3万種のsgRNA※7を個々に発現する細胞ライブラリーを作成しました。この細胞ライブラリーに対して、古典的アストロウイルスの血清型の中で感染細胞の多くが死ぬことが知られている4型を繰り返し感染させ、生存するごく少数の細胞からDNAを採取しました。次世代シーケンスにより採取したDNAを解析し、導入したsgRNA配列の頻度を測ることにより、感染耐性を強く誘導するsgRNAが標的とする遺伝子を同定しました。この結果、胎児性Fc受容体を構成する2つのサブドメインの遺伝子、FCGRTとB2Mがともに複数回のスクリーニングにより検出されました。
(2)胎児性Fc受容体遺伝子が古典的ヒトアストロウイルスの感染に不可欠となる検証
CRISPR-Cas9によるゲノム編集を利用して、胎児性Fc受容体を構成する遺伝子、FCGRTとB2Mをそれぞれ単独に、あるいは同時にノックアウトすると、古典的ヒトアストロウイルスの4型のRNA複製が阻害されました。その阻害は4型にとどまらず、古典的ヒトアストロウイルスの全ての血清型においても同様でした。そして、sgRNAを介してノックアウトした遺伝子を、遺伝子導入にて外来遺伝子として発現させた場合、ウイルスに対する感受性が復活することが明らかになりました。
(3)胎児性Fc受容体遺伝子の発現が古典的ヒトアストロウイルスへの感受性に与える影響
古典的ヒトアストロウイルスの感染標的組織は腸管であり、腸管由来の細胞の中でヒト結腸がん由来であるCaco2細胞が最も感受性が高いと考えられています。一方、腸管由来であっても古典的ヒトアストロウイルスの感受性が低い、あるいはほとんどない細胞もあります。これらの細胞の感受性と、胎児性Fc受容体のサブユニットの遺伝子発現レベルは相関があり、FCGRT、B2Mの発現が低い、あるいは検出できない細胞はほとんどウイルス感受性がありません。一方これらの細胞に対して、FCGRT、B2Mを強制発現すると、古典的ヒトアストロウイルスに対して感受性を示すようになることがわかりました。これらの結果から、胎児性Fc受容体が、古典的ヒトアストロウイルスへの感受性を決定していることが示唆されました。
(4)胎児性Fc受容体遺伝子とウイルスカプシドタンパク質※8の直接結合
最後に、胎児性Fc受容体に対する抗体の中で、古典的ヒトアストロウイルスの感染を阻害する抗体を見出し、その阻害は容量依存的に起こることを明らかにしました。
そして、古典的ヒトアストロウイルスのゲノムを守るカプシドタンパク質の中で、受容体と直接結合することが予想されていたスパイクタンパク質を、大腸菌で組換えタンパク質として発現・精製し、このスパイクタンパク質と胎児性Fc受容体サブユニットの一つが直接結合することを検証しました。さらに既存の構造モデルを利用して、統合計算化学システム※9によりスパイクタンパク質と胎児性Fc受容体の相互作用界面の予測を試みました。その結果、スパイクタンパク質が結合する部位は、本来胎児性Fc受容体が特異的に結合するリガンドであるIgG抗体やアルブミンが結合する部位とは異なることが明らかとなり、ここから研究グループは、胎児性Fc受容体は古典的ヒトアストロウイルスの受容体であると結論づけました。
今後、ウイルスカプシドタンパク質と胎児性Fc受容体の相互作用部位を特定することで、古典的ヒトアストロウイルスの感染予防や治療法の開発に貢献できると期待されます。

【研究代表者のコメント】
中西章(なかにしあきら)
所属:近畿大学生物理工学部 遺伝子工学科
近畿大学大学院生物理工学研究科
職位:教授
学位:博士(農学)
コメント:本研究では、元々安定しなかった感染条件を最適に整え、CRISPR-Cas9によるゲノム編集を利用した遺伝子ノックアウトスクリーンにより、古典的アストロウイルスの感染受容体として胎児性Fc受容体を同定しました。しかしながら、今回の研究では、胎児性Fc受容体とウイルスカプシドタンパク質(スパイクタンパク質)との相互作用界面の同定には至りませんでした。また、新型アストロウイルスが利用する細胞側受容体も解明されていません。アストロウイルスが感染受容体を介してどのように細胞内に侵入するかを明らかにするためには、今後のさらなる研究が必要になりますが、これらの試みを地道に繰り返すことで、小児下痢症を引き起こすウイルスの予防・治療法開発に結び付くと考えています。
【用語解説】
※1 感染受容体:ウイルスがヒトの細胞へ侵入する際に利用する、細胞側のタンパク質。感染受容体がなければウイルスは細胞に侵入することができないため、感染受容体の特定はウイルスによって引き起こされる病気をより詳細に理解するために必須となる。
※2 ノックアウト:遺伝子操作により、特定の遺伝子を欠損(無効化)させること。
※3 細胞ライブラリー:一つひとつの細胞が異なる遺伝子に変異をもつ(ゲノム編集を受けた)細胞集団
※4 IgG抗体:細菌やウイルスが体内に侵入した時に攻撃や排除を担う抗体のうち、IgG抗体は血液中に最も多く分布しており、特にウイルスなどと結合する力が高く、生体防御の役割を担う。
※5 サブユニット:タンパク質が集合し、複合体を形成して生理機能を発現する場合、複合体の構成単位であるタンパク質の一つひとつを「サブユニット」という。
※6 CRISPR-Cas9:ゲノム編集ツールの一つ。微生物の獲得免疫システムを活用することでDNAの二本鎖を切断し、遺伝子を改変する。その簡便さから世界中で広く使用されており、令和2年(2020年)にノーベル化学賞を受賞した。
※7 sgRNA:ガイドRNA。CRISPR-Cas9でのゲノム編集の際に使用する配列で、sgRNAに応じてゲノムを編集することができる。
※8 ウイルスカプシドタンパク質:ウイルスのDNAやRNAを守る役割で、殻のような構造をとっている。
※9 統合計算化学システム:タンパク質、DNA、RNA、脂質や、薬物などを分子レベルで解析できるソフトウェア。
【関連リンク】
生物理工学部 遺伝子工学科 教授 中西章(ナカニシアキラ)
https://www.kindai.ac.jp/meikan/2324-nakanishi-akira.html