あらゆる固形がんを8種に分類するプログラムを開発 がん治療薬である免疫チェックポイント阻害剤の効果を事前予測

近畿大学医学部(大阪府大阪狭山市)産科婦人科学教室主任教授 松村 謙臣と、京都大学大学院医学研究科(京都府京都市)婦人科学産科学教室特定助教 高松 士朗を中心とする研究グループは、約1万症例の固形がん※1 のDNAデータから遺伝子変異の特徴を解析し、あらゆる固形がんを8種に分類する新たなプログラム「GS-PRACTICE」を開発しました。さらに、免疫チェックポイント阻害剤による治療を受けた固形がん患者のデータを解析し、この分類によって、免疫チェックポイント阻害剤の有効性を予測できることを証明しました。
本件に関する論文が、令和4年(2022年)7月22日(金)23:00(日本時間)に、腫瘍、免疫学領域の国際的な科学雑誌"Journal for ImmunoTherapy of Cancer"にオンライン掲載されました。
【本件のポイント】
●約1万症例のDNAデータを解析し、固形がんを8種に分類する新たなプログラムを開発
●8種の分類が、免疫チェックポイント阻害剤の有効性と強く相関することを証明
●固形がんに対する免疫チェックポイント阻害剤の効果を予測し、予後改善に役立てることにつながる研究成果
【本件の背景】
がんは遺伝子変異によって発症しますが、一方で、遺伝子変異があると異常なタンパク質が作られ、免疫細胞はそれを目印としてがんを攻撃します。がんはその攻撃から逃れて増殖するために、「免疫チェックポイント」と呼ばれる免疫を抑える仕組みを利用しています。近年、従来の抗がん剤治療が効かない患者にも長期的な治療効果をもたらす有望な治療法として「免疫チェックポイント阻害剤」が注目されています。これはがんに対する免疫を強めるもので、メラノーマなど特定のがんにおいて高い効果を示しますが、すべてのがんに有効というわけではありません。
免疫チェックポイント阻害剤が有効なのは、特に遺伝子変異の量が多く、免疫細胞に攻撃されやすい目印をたくさん持ったがん細胞です。しかし、遺伝子変異の量があまり多くなくても、効果のあるがん細胞があることも知られています。免疫チェックポイント阻害剤が有効ながんであるかどうかを、治療前に判断する手法の開発が強く望まれています。
【本件の内容】
研究グループは、免疫チェックポイント阻害剤の効果には、遺伝子変異の量だけでなく、遺伝子変異が生じた原因も影響を与えるのではないかという仮説を立て、遺伝子変異のパターンに着目しました。
まず、米国の大型がんゲノムプロジェクト(TCGAプロジェクト※2 )に登録された約1万症例の様々な種類の固形がんについて、遺伝子変異のパターンを解析しました。その結果、あらゆる固形がんは8種に分類でき、特に、喫煙、紫外線などの外的要因が原因で遺伝子変異した5種は、免疫チェックポイント阻害剤の効果に関連する遺伝子発現が高いことを明らかにしました。また、このデータを基に、固形がんを遺伝子変異パターンに応じて、免疫応答性の高さで分類するプログラム「GS-PRACTICE」を開発しました。さらに、このプログラムを用いて、免疫チェックポイント阻害剤による治療を受けた症例973件を分類したところ、「GS-PRACTICE」による分類と免疫チェックポイント阻害剤の効果の有無が強く相関することを明らかにしました。
本研究結果は、「GS-PRACTICE」があらゆる固形がんに対する免疫チェックポイント阻害剤の効果予測に役立つことを証明するもので、今後、臨床への応用が期待されます。
【論文概要】
掲載誌:
Journal for ImmunoTherapy of Cancer(インパクトファクター:12.469 @ 2021-2022)
論文名:
Mutation burden-orthogonal tumor genomic subtypes delineate responses to immune checkpoint therapy
(腫瘍ゲノムサブタイプは、免疫チェックポイント治療に対する反応を規定する)
著者:高松 士朗1、濵西 潤三1、J.B. Brown2,3、山口 建1、山ノ井 康二1、村上 幸祐4、後藤 理5、森 誠一5、万代 昌紀1、松村 謙臣4 ※ ※ 責任著者
所属:
1 京都大学大学院医学研究科婦人科学産科学教室、
2 京都大学大学院医学研究科分子バイオサイエンス研究室、
3 京都大学大学院医学研究科附属がん免疫総合研究センター、
4 近畿大学医学部産科婦人科学教室、
5 がん研究会がんプレシジョン医療研究センター次世代がん研究シーズ育成プロジェクト
【研究の詳細】
研究グループは、メラノーマや肺がんに対する免疫チェックポイント阻害剤の効果は、紫外線や喫煙のような外的要因によって遺伝子変異が生じる場合は高く、年齢のような内的要因によって生じる場合は低い、という報告があることに着目しました。そして、遺伝子変異量だけではなく、遺伝子変異が生じた原因も免疫チェックポイント阻害剤の効果に影響を与えるという仮説を立てました。その仮説のもとで、様々な固形がんに対して活用できる、臓器横断的な免疫チェックポイント阻害剤のバイオマーカー※3 の開発を目指しました。
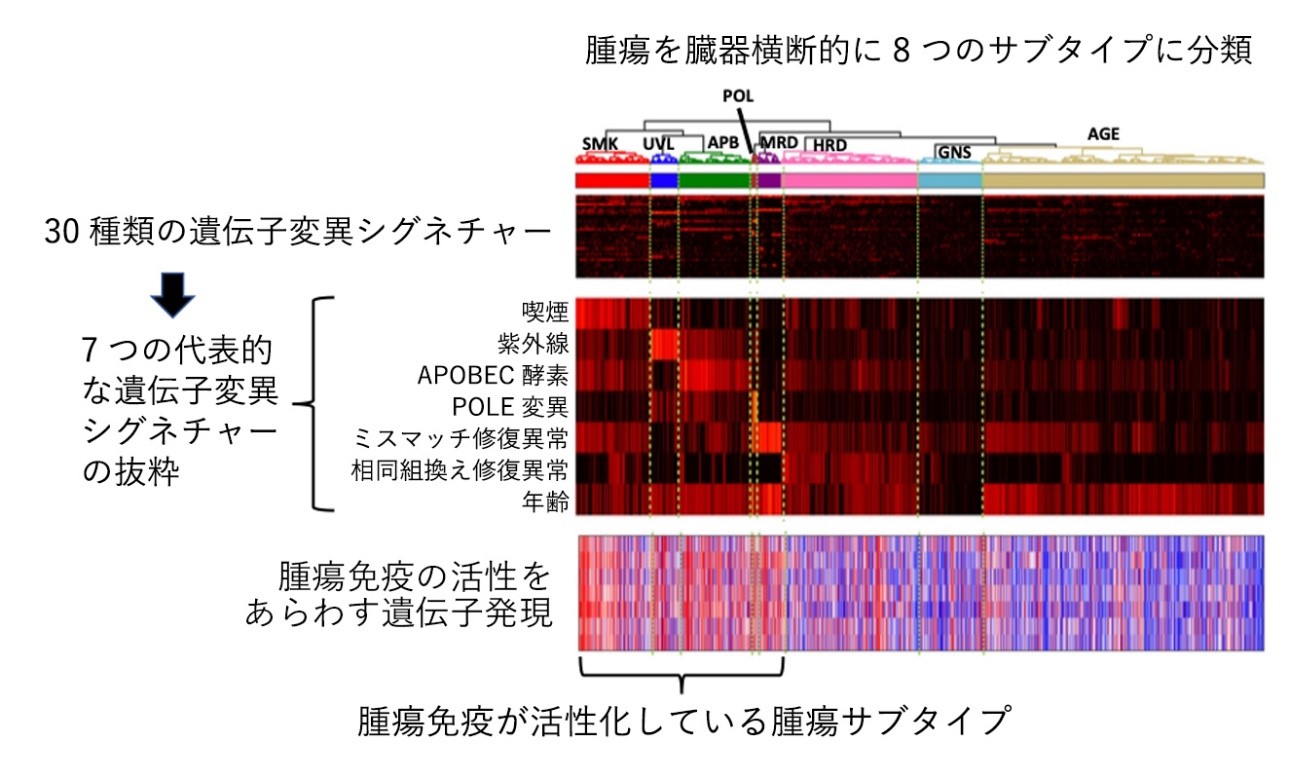
まず、TCGAプロジェクトに登録された約1万症例の固形がんの全エクソンシークエンシングデータ※4 から、30種類の遺伝子変異のパターン(遺伝子変異シグネチャー※5 )がどの程度認められるかを数値化し、階層性クラスタリング※6 によって分類しました。そして臓器横断的に、遺伝子変異の原因となる特徴を持つ7つのサブタイプ(喫煙(SMK)、紫外線(UVL)、APOBEC酵素(APB)、POLE変異(POL)、ミスマッチ修復異常(MRD)、相同組換え修復異常(HRD)、年齢(AGE))、あるいはいずれも持たないゲノム安定性(GNS)のサブタイプ、という8種に分類しました。さらに、データの約1/3を占める、前者の5つのサブタイプ(SMK、UVL、APB、POL、MRD)に分類される腫瘍は、腫瘍免疫や免疫チェックポイント阻害剤の効果に関連する遺伝子発現が高いサブタイプ(immuno-responsive genomic subtype)であることも明らかにしました。これは、遺伝子変異が生じる原因が、臓器の分類をこえて、腫瘍免疫の活性化に関連する可能性を示すものです。

この結果から、機械学習によって、腫瘍を8つのサブタイプに分類するプログラム「GS-PRACTICE」を開発しました。「GS-PRACTICE」によって、その腫瘍が腫瘍免疫活性の高いサブタイプか否かを調べることができます。
さらに、免疫チェックポイント阻害剤による治療を受けた、様々な種類のがんのデータ973症例を「GS-PRACTICE」で解析したところ、腫瘍免疫活性の高いサブタイプの腫瘍は、免疫チェックポイント阻害剤によって縮小しやすく、生存期間が延長する傾向にあることも分かりました。なお、「GS-PRACTICE」は、病理診断のために診療で日常的に作成される、ホルマリン標本から抽出したDNAを用いても解析できるため、臨床応用が容易です。
本研究結果から、「GS-PRACTICE」が新たな臓器横断的なバイオマーカーとして有用であり、免疫チェックポイント阻害剤の有効性が予測できることが明らかになりました。「GS-PRACTICE」による予測は予後の改善に非常に有効であり、今後の臨床への応用が期待されます。
【用語解説】
※1 固形がん:血液がん以外の、がん細胞が臓器や組織上に集まってできるがんの総称。
※2 TCGAプロジェクト:The Cancer Genome Atlasプロジェクトの略。2006年から米国で開始された大型がんゲノムプロジェクト。20種類以上のがん種について、ゲノム・メチル化異常、遺伝子・タンパク質発現異常を網羅的に解析し、HPにてデータを公開しているもの。
※3 バイオマーカー:疾患の有無、病状の変化を示す指標となる項目や、生体内の物質。バイオマーカーの代表例として、血圧、心拍数、血中のタンパク質といったものが挙げられる。
※4 全エクソンシークエンシングデータ:全てのエクソン(遺伝情報がコードされている領域)において、変異の有無を調べたデータ。
※5 遺伝子変異シグネチャー:遺伝子変異を生じる原因ごとの遺伝子変異のパターン。
※6 階層クラスタリング:データを比較し、似ているものをクラスタとしてまとめ、グルーピングしていく手法。
【関連リンク】
医学部 医学科 教授 松村 謙臣(マツムラ ノリオミ)
https://www.kindai.ac.jp/meikan/2124-matsumura-noriomi.html
医学部 医学科 医学部講師 村上 幸祐(ムラカミ コウスケ)
https://www.kindai.ac.jp/meikan/1898-murakami-kosuke.html