ヒトの着床に関わる新たな制御機構を解明

【発表のポイント】
●核内アクチンの挙動を可視化できる子宮内膜間質細胞を樹立し、着床や妊娠の維持に必須である脱落膜化現象の研究に使用しました。
●ヒト胚の着床に必要となる脱落膜化が、細胞核内でのアクチンタンパク質の動態変化によって制御されることを世界で初めて明らかにしました。
●また、核内アクチン集合体を制御する因子として、転写因子C/EBPβを同定しました。
●ヒトの着床に関わる新たな機構が明らかになるとともに、着床不全による不妊症患者に対する治療法の開発に貢献することが期待されます。
【研究概要】
山口大学(学長:谷澤幸生)の大学院医学系研究科産科婦人科学講座(田村功講師、杉野法広教授)と九州大学(総長:石橋達朗)の大学院農学研究院動物繁殖生理学分野(宮本圭教授(2024年3月まで近畿大学所属))の研究グループは、ヒト胚の着床※1 に必要となる脱落膜化※2 という現象が、細胞核内でのアクチン※3 タンパク質の動態変化によって制御されることを世界で初めて明らかにしました。
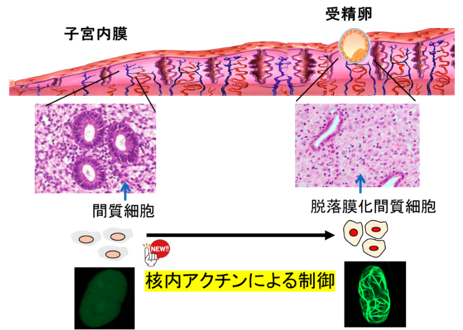
着床とは、受精卵が子宮内膜に接着・浸潤する妊娠成立のための最初のステップです。この過程では、子宮内膜で様々な変化が誘導され受精卵を受け入れることができるようになります。そのうちの一つである子宮内膜間質細胞の脱落膜化は、ホルモンの影響により細胞が機能的にも形態学的にも劇的に変化する特有の現象であり、着床や妊娠の維持に必須の現象です。脱落膜化が障害された場合は、受精卵を受け入れることができず着床不全となり不妊症となります。この脱落膜化の調節機構は未だ完全には明らかにされていません。
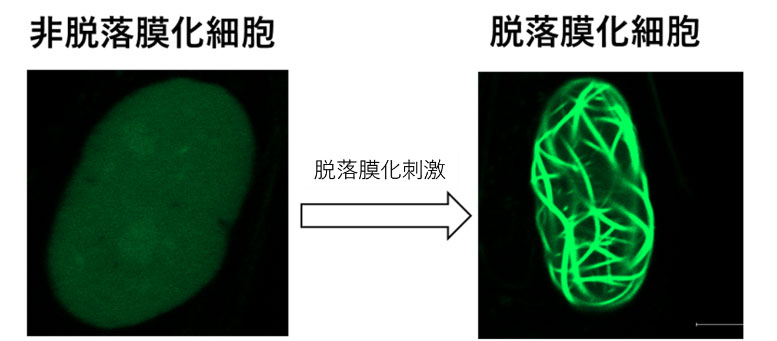
近年、細胞骨格の構成組織であるアクチンタンパク質は、細胞質だけではなく核内にも存在することが明らかとなってきており、その遺伝子発現※4 制御への役割が着目されています。研究グループは、脱落膜化を受けるヒト細胞核内の変化を観察したところ、アクチンが重合し繊維化した特殊な構造体が出来上がることを発見しました(図1)。またこの核内アクチンの繊維化は、脱落膜化の誘導に重要な役割を持っていることを示しました。本研究によってヒトの着床に関わる新たな機構が明らかになるとともに、着床不全による不妊症患者に対する治療法の開発に貢献することが期待されます。
本研究は、文部科学省科学研究費補助金による研究課題『核内Fアクチン形成によるヒト子宮内膜間質細胞の脱落膜化機構の解明』(研究代表者:田村功)、文部科学省科学研究費補助金その他9件、文部科学省科学研究費補助金による研究課題『全能性細胞の核構築原理』、および武田科学振興財団 ライフサイエンス研究継続助成による研究課題『核内アクチンタンパク質の生物学的意義の解明への助成』(研究代表者:宮本圭)の支援を受けて行われました。
本研究成果は、2024年7月11日付(ロンドン時間午前10時)で、Communications Biologyに掲載されました。
【研究内容】
着床の場である子宮内膜では、受精卵を受け入れるために多くの変化が誘導され、これにより着床・妊娠が成立します。そのうちの一つである子宮内膜間質細胞の脱落膜化は、細胞が機能的にも形態学的にも劇的に変化する特有の現象であり、着床や妊娠の維持に必須の現象です。脱落膜化が障害された場合は、受精卵を受け入れることができず着床不全となり不妊症の一因となります。私たちはこれまで、脱落膜化の過程では多くの遺伝子発現変化とそれに伴う細胞機能変化が起こり、着床に貢献していることを報告してきました。しかし、脱落膜化の調節機構は未だ完全には明らかとなっていませんでした。
細胞骨格の構成組織であるアクチンタンパク質は細胞質に存在し、細胞の形態変化に関与していることは多くの細胞で知られています。興味深いことに、近年、アクチンは核内に存在することが明らかとなっており、遺伝子発現制御への役割が着目されています。そこで、私たちは核内アクチンと脱落膜化の関係について迫ることとしました。
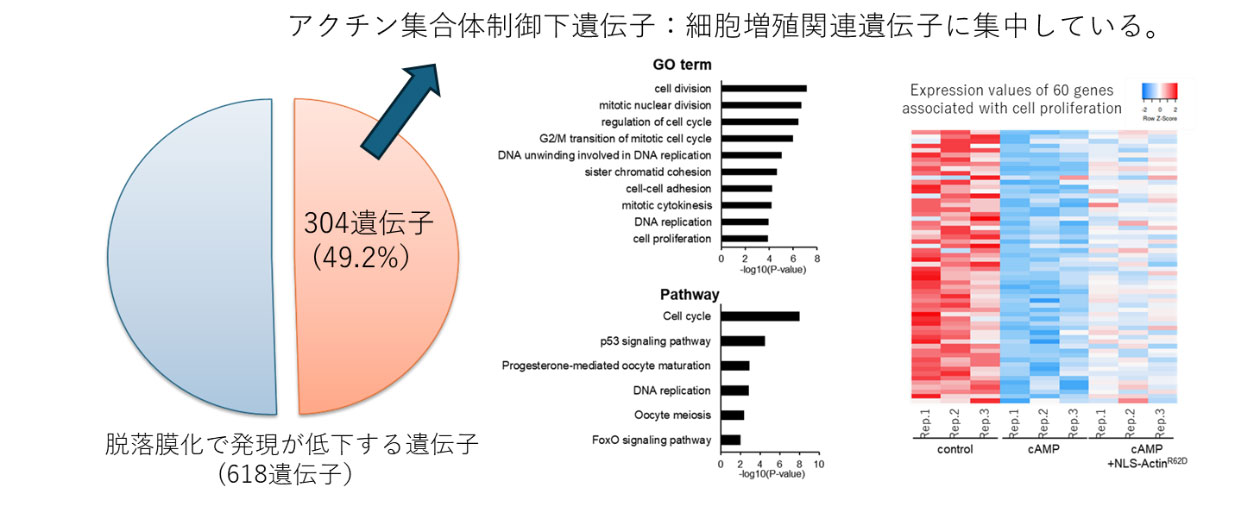
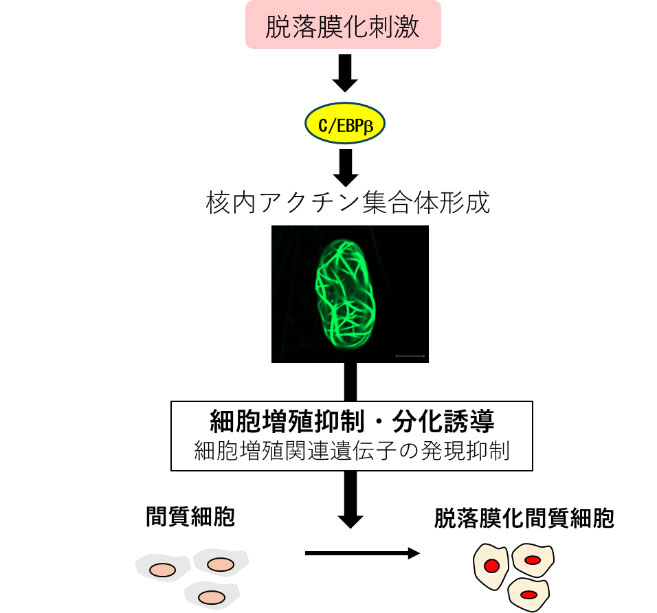
まず私たちは、GFPタンパクで標識された核内アクチン可視化プローブを発現することで、核内アクチンの挙動をリアルタイムに可視化できる子宮内膜間質細胞を樹立しました。この細胞を用いて脱落膜化反応を誘導したところ、脱落膜化すると、GFPシグナルが線状に凝集した核内アクチン集合体が出現することを発見しました(図1)。興味深いことに、細胞の脱落膜化が解消し、元の細胞の状態に戻ると核内アクチンの集合体も消失しました。さらに、このアクチン集合体の形成を人為的に阻害すると脱落膜化が抑制されたことから、核内アクチン集合体の形成は脱落膜化に必須な調節機構であることが明らかとなりました。次に、核内アクチン集合体の形成により制御される遺伝子をRNAシークエンス解析で網羅的に調べました。脱落膜化で発現が低下する618遺伝子のうち、約半分もの304遺伝子が核内アクチン集合体形成により制御されていることがわかりました。また、これらの遺伝子の多くは細胞増殖に関連する遺伝子に集中していたことから、核内アクチン集合体形成は細胞増殖抑制に働いていると考えられました(図2)。脱落膜化というのは一種の分化現象で、この過程では、細胞増殖が止まり分化にスイッチされることが必須です。よって、核内アクチン集合体の形成により細胞増殖が停止し脱落膜化という分化へのスイッチが誘導されているのは非常に理にかなった反応と考えられます。さらに、私たちは、核内アクチン集合体形成を制御する因子として、転写因子C/EBPβを同定することに成功しました(図3)。核内アクチン集合体形成を制御する因子は他細胞でも報告が少なく非常に重要な知見を得ることができました。今回の発見は、核内アクチンを介した脱落膜化制御の新しいメカニズムを示すだけでなく、着床への関与という新たな核内アクチンの役割を示すものです。本研究によって今まで知られていなかった着床機構が明らかになるとともに、核内アクチンやその制御因子であるC/EBPβをターゲットとした新たな着床不全に対する治療法の開発に貢献することが期待されます。



【用語解説】
※1. 着床
卵子と精子の受精によってできた受精卵が、子宮内の子宮内膜に接着すること。妊娠の最初のステップである。様々な原因で子宮内膜の機能が障害されると着床不全となり不妊症の一因となる。
※2. 脱落膜化
子宮内膜は主に上皮細胞と間質細胞により構成されるが、間質細胞は着床期に向けて脱落膜化という細胞の形態的・機能的分化を遂げる。この過程は妊娠の成立・維持に必須な現象であり、脱落膜化の障害は着床不全の原因となる。脱落膜化過程では着床現象に必要な多くの遺伝子発現変化と細胞機能変化が誘導される。
※3. アクチン
細胞骨格の構成因子であり、これまでは、細胞質のみに存在すると考えられていた。しかし、近年の研究によりアクチンは核内にも存在することが分かってきた。さらに、アクチンは単量体または、それらの重合体の状態で存在しており、遺伝子発現制御を含めた核内の様々なイベントに関わっていると考えられている。
※4. 遺伝子発現
細胞核内にはゲノムDNAがあり、RNAへと転写され、最終的にRNAからタンパク質がつくられる。この一連の流れを遺伝子発現とよび、私たちが生命活動を行うために必須の現象である。
【論文題目と著者】
Nuclear actin assembly is an integral part of decidualization in human endometrial stromal cells
Isao Tamura, Kei Miyamoto, Chiharu Hatanaka, Amon Shiroshita, Taishi Fujimura, Yuichiro Shirafuta, Yumiko Mihara, Ryo Maekawa, Toshiaki Taketani, Shun Sato, Kazuya Matsumoto, Hiroshi Tamura, Norihiro Sugino
「核内アクチン集合体形成はヒト子宮内膜間質細胞の脱落膜化の調節機構の一つである」
田村功(責任著者)、宮本圭(共第一著者、責任著者)、畑中千春、城下亜文、藤村大志、白蓋雄一郎、三原由実子、前川亮、竹谷俊明、佐藤俊、松本和也、田村博史、杉野法広
掲載誌:Communications Biology
DOI :10.1038/s42003-024-06492-z
【関連リンク】
生物理工学部 遺伝子工学科 教授 松本和也(マツモトカズヤ)
https://www.kindai.ac.jp/meikan/488-matsumoto-kazuya.html