受精卵の発生に重要な因子を発見 ―ヒストンのアルギニンジメチル化が重要―

近畿大学生物理工学部 遺伝子工学科 松本 和也 教授、京都大学大学院 医学研究科 附属動物実験施設 守田 昂太郎 特定助教らの研究グループは、マウス受精卵を用いた研究により胚発生に重要な因子を発見しました。
生命の始まりの細胞である受精卵は、受精後に全ての細胞へ分化できる能力(全能性)を獲得することで体を形作ることができるようになります。全能性を獲得するまでに、受精卵の核内ではリプログラミングと呼ばれる現象が起こり、精子と卵子由来のDNAに記録された遺伝子発現を制御するための情報がリセットされ、受精卵は新しく遺伝子発現を開始します。しかしながら、この過程の詳しい分子機構は不明な点が多いです。
本研究では、リプログラミングに関与する候補因子の中から、ごく初期の胚において未だ機能が明らかになっていないアルギニンメチル基転移酵素PRMT5とPRMT7に注目し、これらの酵素によってヒストンタンパク質(H3)の2番目のアルギニンに付加された対称性ジメチル化修飾(H3R2me2s)が、胚発生に必須とされるゲノムの活性化に重要な働きをすることがわかりました。
本成果は、2021年5月12日に英国の国際学術誌「Scientific Reports」にオンライン掲載されました。
【背景】
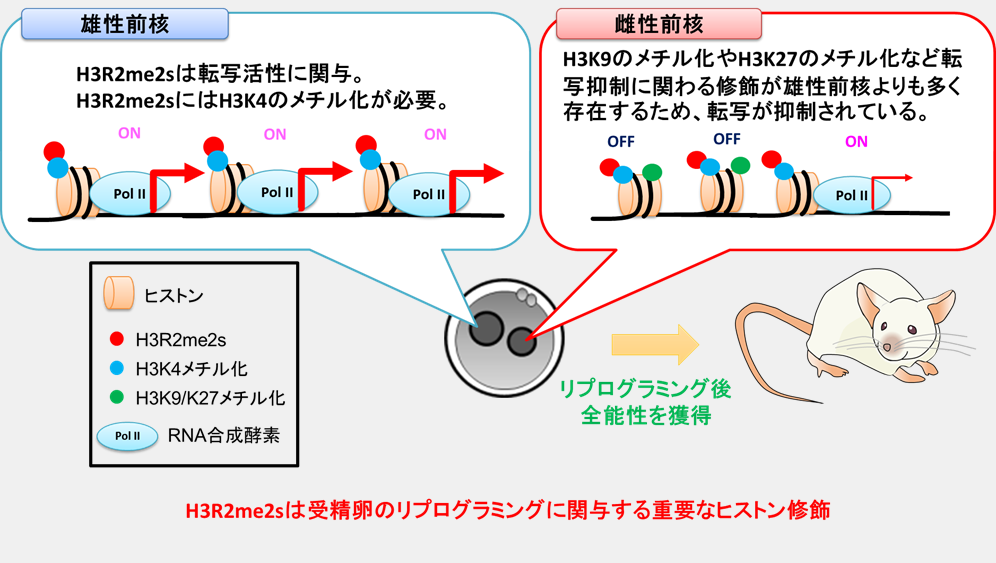
受精卵は全能性と呼ばれる能力を獲得することで、体を構成する全ての細胞へ分化することができるようになります。体細胞や生殖細胞の精子と卵子では、DNAやヒストンタンパク質に付加されたメチル化修飾※1 が細胞固有の遺伝子発現になるように制御していますが、受精後はそれらの情報がリセットされ、ゲノム全体から積極的に遺伝子が発現する胚性ゲノムの活性化※2 が起こります。これらの現象を核内のリプログラミングと呼び、受精卵が全能性を獲得するためには必要とされています。受精卵の前核期※3 では、雌性前核よりも雄性前核においてメチル化修飾の変化や遺伝子発現が活発に起こることがわかっています。しかしながら、リプログラミングが生じる分子機構についての詳細は解明されていない点が多く残されています。これまでの我々の研究で、Mettl23というアルギニンメチル基転移酵素※4 によってヒストンH3※5 を構成するアミノ酸17番目のアルギニンに付加された非対称性ジメチル化修飾※6 (H3R17me2a)が受精直後のリプログラミングに必須であることを明らかにし、アルギニンの修飾が受精時に重要であることを解明しました。他のグループの報告では、アルギニンメチル基転移酵素のPRMT5やPRMT7がどちらも卵子や受精後の初期胚に豊富に存在していることを明らかにされています。PRMT5及びPRMT7はヒストンH2Aの3番目、H3の2番目と8番目、H4の3番目のアルギニンに対称性ジメチル化修飾※7 を付加することも明らかにされています(H2AR3me2s、H3R2me2s、H3R8me2s、H4R3me2s)。しかしながら、これらの酵素によって修飾されるアルギニンジメチル化の役割については不明です。そこで本研究では、リプログラミングに関わる新たな知見を得るため、これらの修飾の中から初期発生に重要なヒストン修飾を探しました。
【研究手法・成果】
PRMT5及びPRMT7が付加するヒストン修飾の中で胚発生に重要な修飾を調べるため、これらのヒストン修飾が付加されないようにアルギニンをアラニンに置換した変異体(H2AR3A、H3R2A、H3R8A、H4R3A)を受精卵の前核に取り込ませた結果、H3R2Aを核内に取り込ませた受精卵だけが2細胞期で停止することが明らかになりました(図1)。

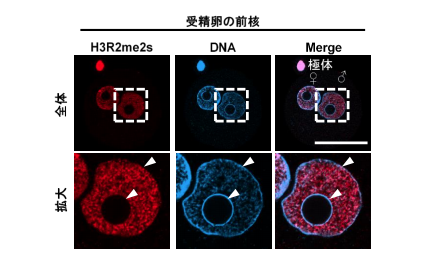
そこでH3R2me2sに焦点を当て、受精卵の前核内におけるH3R2me2sの局在を調べた結果、遺伝子発現が積極的に行われているユークロマチン領域※8 に認められ、遺伝子発現が行われないヘテロクロマチン領域※9 にはほとんど認められませんでした(図2)。

これらの結果から、H3R2me2sは受精卵の遺伝子発現に関与している可能性が示唆されました。次に、実際にH3R2me2sが胚性ゲノムの活性化に関与しているかどうかを調べるために、H3R2me2sの取り込み阻害やPRMT5とPRMT7の機能を抑制することによって核内のH3R2me2sを減少させた結果、ゲノム全体のRNA合成や転写に関与するRNA合成酵素の活性が低下することがわかりました。これらのことから、受精卵におけるH3R2me2sは受精卵の胚性ゲノム活性化に重要な新規のヒストン修飾であることがわかりました。
これまでの報告では、転写活性に重要なヒストン修飾としてよく研究されているヒストンH3の4番目のリシン(H3K4)のメチル化が胚性ゲノムの活性化に重要であることが明らかにされています。そこで、H3R2me2sとH3K4のメチル化との関係を調べた結果、H3K4のメチル化を阻害した場合に核内におけるH3R2me2sの蓄積が抑制されました。
以上のことから、胚性ゲノムの活性化に関与するH3R2me2sの修飾にはH3K4のメチル化が関係していることが示唆されました(図3)。
【波及効果、今後の予定】
本研究によって受精後の発生に重要なヒストン修飾が新たに発見されましたが、リプログラミングに関する機構はまだ不明な点が多いです。今回明らかになったヒストン修飾H3R2me2sを糸口にさらなるリプログラミング研究が進み、全能性獲得機構の理解につながることが期待されます。また、様々な細胞へ分化できるES細胞やiPS細胞等の樹立時にもリプログラミングが生じているため、その際にH3R2me2sも関与することが明らかになれば、再生医療の分野への発展も期待されます。
【研究プロジェクトについて】
本研究成果は以下の研究課題によって得られました。
●日本学術振興会 科学研究費助成事業 基盤研究(B)(25292189)
2013年4月 - 2017年3月 代表者:松本 和也
●日本学術振興会 科学研究費助成事業 基盤研究(B)(20H03134)
2020年4月 - 2024年3月 代表者:松本 和也
●日本学術振興会 科学研究費助成事業 若手研究(A)(17H05045)
2017年4月 - 2021年3月 代表者:宮本 圭
●日本学術振興会 科学研究費助成事業 新学術領域研究(研究領域提案型)(19H05271)
2019年4月 - 2020年3月 代表者:宮本 圭
●日本学術振興会 科学研究費助成事業 新学術領域研究(研究領域提案型)(19H05751)
2019年6月 - 2024年3月 代表者:宮本 圭
●一般財団法人 藤原記念財団 令和元年度少壮研究者奨励金
2019年7月 - 2020年3月 代表者:守田 昂太郎
●日本学術振興会 科学研究費助成事業 若手研究(20K15700)
2020年4月 - 2023年3月 代表者:守田 昂太郎
<用語解説>
※1 メチル化修飾
メチル基転移酵素によってDNAやヒストンにメチル基が付加された状態。メチル化されたDNAの領域ではRNAの転写が抑制されている。また、ヒストンの場合、メチル基が付加されるアミノ酸によって転写活性か転写抑制の機能が決まる。
※2 胚性ゲノムの活性化
受精卵のゲノム全体から遺伝子発現が起こる。2細胞期でもこの現象が起こるが、転写産物の量はさらに増え、受精卵とは異なった領域からも遺伝子が発現する。胚性ゲノムの活性化時に転写されるRNAはすでに明らかにされているが、どのように転写が活性化されるのか詳しい仕組みは解明されていない。
※3 受精卵の前核期
受精直後、精子由来のDNAと卵子由来のDNAがそれぞれ個別に核を形成し、雄性前核と雌性前核となる。前核期は受精卵がこれらの前核を2つ持っている期間を指す。マウスの場合は受精から約12時間程度は前核が存在しており、DNA複製を終えた前核期の後期では、雌雄の前核が崩壊して分裂期へと移行する。
※4 アルギニンメチル基転移酵素
タンパク質を構成しているアミノ酸の中で特定のアルギニンにメチル基を2つ付加(ジメチル化)する酵素。酵素の種類によりどのアミノ酸配列のアルギニンにメチル基を付加するかが決まっている。それに加え、アルギニン側鎖の末端にある2つの枝分かれした窒素原子の片方にメチル基を2つ付加するタイプと両方の窒素原子にメチル基を一つずつ付加するタイプに分けられる。
※5 ヒストンH3
ヒストンを構成するタンパク質の一つ。ヒストンはH2A、H2B、H3、H4の4種類のタンパク質が2つずつ集った8つの分子で構成される。DNAがヒストンに巻きついた構造をヌクレオソーム、ヌクレオソームが高次構造を取ったものが染色体である。
※6 非対称性ジメチル化修飾
アルギニン側鎖の末端にある2つの枝分かれした窒素原子の一方にメチル基が2つ付加された状態。
例えば、ヒストンH3の17番目のアルギニンの非対称性ジメチル修飾の場合はH3R17me2aと表記される。
「R」はアルギニン、「a」は非対称(asymmetry)を指す。
※7 対称性ジメチル化修飾
アルギニン側鎖の末端にある2つの枝分かれした窒素原子の両方にメチル基が1つずつ付加された状態。
例えば、ヒストンH3の2番目のアルギニンの対称性ジメチル修飾の場合はH3R2me2sと表記される。
「s」は対称(symmetry)を指す。
※8 ユークロマチン領域
DNAとヒストンを含むDNA結合タンパク質をまとめてクロマチンと呼ぶ。そのクロマチンが緩んだ領域。
通常、クロマチンが緩んだ領域では遺伝子発現が起こりやすい。
※9 ヘテロクロマチン領域
クロマチンが凝集した状態。クロマチンが凝集した領域は遺伝子発現が抑制されている。
<研究者のコメント>
同じアルギニン残基がジメチル化される場合でも、対称性ジメチル化修飾か非対称性ジメチル化修飾かによって機能は異なります。受精卵での研究が難しい分野ではありますが、胚発生に重要なアルギニンメチル化修飾が他にも存在している可能性は十分あります。今回に続き、アルギニンメチル化修飾に関する知見がこれからも増え、初期胚のリプログラミング機構の理解に繋がることを願っております。
<論文タイトルと著者>
タイトル:
Symmetrically dimethylated histone H3R2 promotes global transcription during minor zygotic genome activation in mouse pronuclei
(対称性ジメチル化H3R2はマウス前核内の胚性ゲノム活性化の間、ゲノム全体の転写を促進する)
著 者:
Kohtaro Morita, Yuki Hatanaka, Shunya Ihashi, Masahide Asano, Kei Miyamoto, Kazuya Matsumoto
(守田 昂太郎、畑中 勇輝、井橋 俊哉、浅野 雅秀、宮本 圭、松本 和也)
掲載誌 :DOI:10.1038/s41598-021-89334-w
【関連リンク】
生物理工学部 遺伝子工学科 教授 松本 和也(マツモト カズヤ)
https://www.kindai.ac.jp/meikan/488-matsumoto-kazuya.html
生物理工学部 遺伝子工学科 准教授 宮本 圭(ミヤモト ケイ)
https://www.kindai.ac.jp/meikan/1353-miyamoto-kei.html