「Mre11」という酵素の2つの活性によるDNAの修復機構を解明 細胞のがん化を防ぐ根幹の仕組みの理解にも繋がる研究成果

近畿大学農学部(奈良県奈良市)生物機能科学科教授 篠原美紀と、近畿大学大学院農学研究科バイオサイエンス専攻博士前期課程2年 玉井智貴(執筆当時)、同2年 尾尻龍星、同2年 森田一世(執筆当時)の研究グループは、イタリア スヴィッツェラ大学(スイス)およびニュージャージー州立ラトガース医科大学(アメリカ)との共同研究により、細胞内でDNAが損傷を受けて断裂した場合に、修復に必須となる「Mre11※1」という酵素が2種類の活性を切り替えることで、損傷の状態に応じて異なる修復を行うことを明らかにしました。
DNAの修復に失敗して遺伝情報が書き換わると、細胞ががん化することが知られており、本研究成果は、がんを防ぐ仕組みの理解にも繋がることが期待されます。
本研究に関する論文が、令和6年(2024年)8月22日(木)に、学術雑誌"Nature Communications(ネイチャー コミュニケーションズ)"に掲載されました。
【本件のポイント】
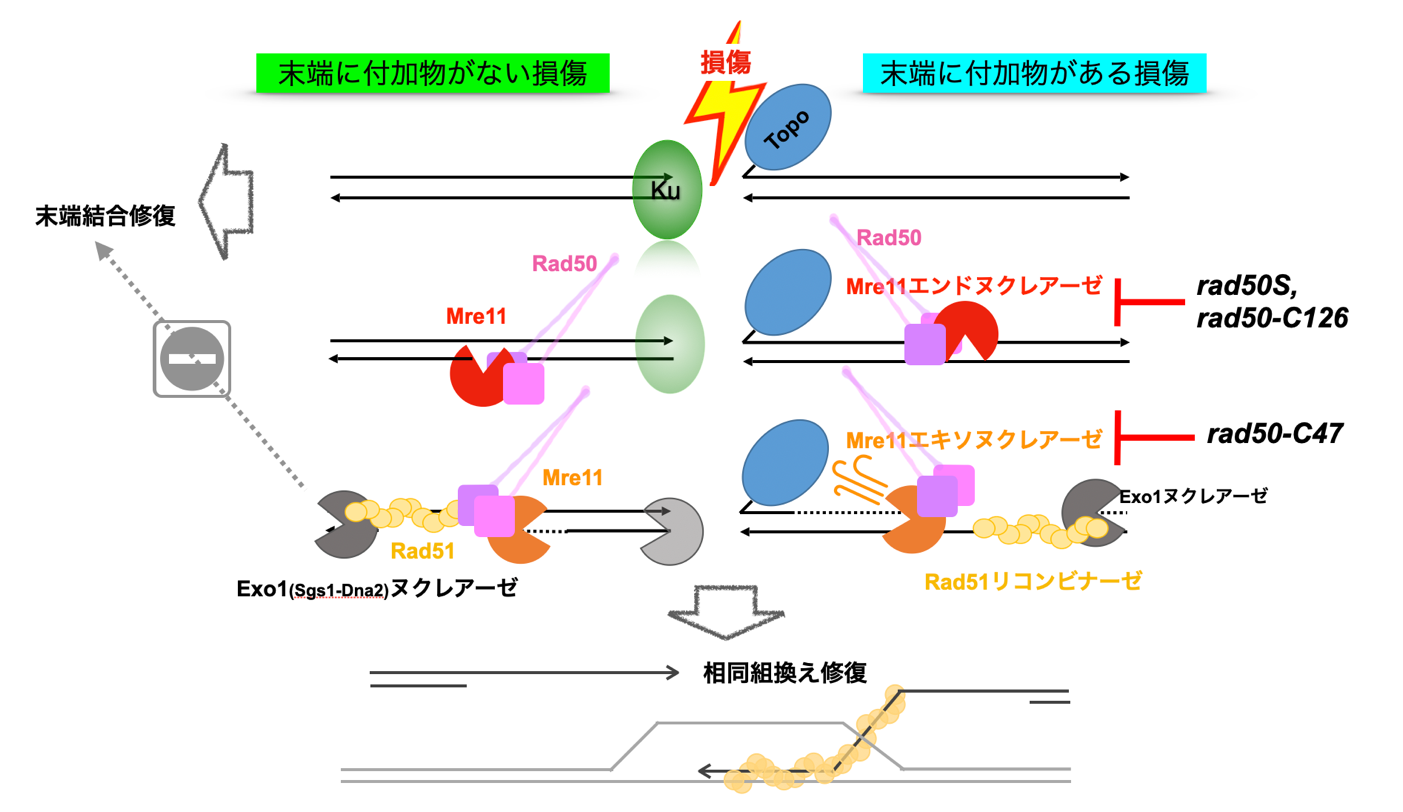
●DNAを守るための鍵因子である「Mre11」は、Rad50とSae2によって2つの活性を切り替えられることで、DNAの損傷状態に応じた修復を行うことを解明
●断裂したDNAの末端に付加物がある場合、修復には両方の活性が必須である一方、付加物がない場合は片方の活性で修復可能であることを明らかに
●本研究成果は、DNAの修復ミスが原因で生じる、細胞のがん化を防ぐ仕組みの理解にも繋がると期待
【本件の背景】
生物の遺伝情報の源であるDNAは、細胞の中で絶えず傷を負っています。生物はその傷の種類に応じた修復方法を備えており、遺伝情報が変更されないように守っています。しかし、傷を修復しても、その傷がもとで遺伝情報が書き換わってしまうと細胞ががん化することがわかっています。
一方、DNAの正しい修復方法を選択する鍵因子およびがん抑制因子として、「Mre11」という核酸を分解する酵素が知られています。多くの真核生物では、DNA二本鎖が断裂するような損傷を受けた場合、二本鎖のうち一方がMre11により削られて露出し、その部分にDNAを修復するタンパク質が結合することが先行研究により明らかとなっています。
Mre11は、核酸を内部から分解する活性と、末端から分解する活性の2つを持ち、損傷の状態に応じてこれらを使い分けていると考えられています。しかし、どのような場合に2つの活性を使い分けるのか、どのようにして2つを切り替えるのかについてはこれまで不明でした。
【本件の内容】
研究グループは、パン酵母を用いてMre11の2種類の酵素活性のうち、片方だけが全く機能しない変異株を単離することに初めて成功しました。この変異株を用いて、さまざまな種類の断裂したDNAを修復できるかについて検討した結果、DNAの末端にタンパク質が付加した場合に、一般的な修復過程で生じるMre11によるDNAの切れ目は検出されたものの、その後の修復が全く進まないことが明らかになりました。なお、この研究の過程で、Mre11によってできるDNAの切れ目は、断裂末端から等間隔に入っており、特徴的な酵素活性を持つことも明らかになりました。
この結果から、DNA断裂末端に付加物がある場合には、Mre11は酵素活性によって付加物のできるだけ近くに複数のDNAの切れ目をつくり、その後もう一つの酵素活性に切り替えて、付加物をDNA末端から取り除くことによってDNAの修復を進めるということが示されました。また、付加物がないDNA断裂末端の修復は、一種類の酵素活性だけで可能であることも明らかにしました。
本研究成果は、DNA断裂末端に付加物をつけることで効果を示す抗がん剤の効果を、Mre11の活性が打ち消してしまうことを示しており、Mre11の2つの活性を特異的に制御することで、抗がん剤への抵抗性や抗がん剤の効果の制御に繋がることが期待されます。
【論文概要】
掲載誌:
Nature Communications(インパクトファクター:14.7@2023)
論文名:
Sae2 controls Mre11 endo- and exonuclease activities by different mechanisms.
(Sae2タンパク質はMre11のエンドヌクレアーゼとエキソヌクレアーゼ活性の両方を異なる機構で制御する)
著者 :
玉井智貴1,2、Giordano Reginato3、尾尻龍星1,2、森田一世1,2、Alexandra Avrutis4、Petr Cejka3,、篠原美紀1,2,、Katsunori Sugimoto4,*
*共同責任著者
所属 :
1 近畿大学大学院農学研究科、2 近畿大学アグリ技術革新研究所、3 イタリア スヴィッツェラ大学(スイス)、4 ニュージャージー州立ラトガース医科大学(米国)
DOI :10.1038/s41467-024-51493-5
URL :https://doi.org/10.1038/s41467-024-51493-5
【研究の詳細】
酵母において、Mre11は、Rad50とXrs2というタンパク質と複合体を形成し、この複合体がSae2というタンパク質と協調することで、DNAの切除を行うことが知られています。また、Mre11が細胞内で機能するためには、Rad50とSae2の両方が重要であることも明らかになっています。
そこで研究グループは、まず、Rad50の遺伝子変異をもつパン酵母Saccharomyces cerevisiae(サッカロマイシス セルビシエ)の中から、Mre11が機能しなくなる変異株を単離しました。これまでもMre11の2つのヌクレアーゼ※2 活性の両方に欠損を示すようなRad50遺伝子変異は知られています。しかし、今回新しく単離した変異株の中に、エンドヌクレアーゼ※3 活性には欠損がない一方で、3'-5'エキソヌクレアーゼ※4 活性は全く機能しない新しい変異株が含まれていることを見つけ出しました。
さらに、精製したMre11タンパク質によるDNAの加水分解反応に、精製したSae2および、野生型あるいは変異型Rad50タンパク質をそれぞれ加えると、Mre11の活性が変化することも明らかにしました。そこで、このRad50変異株を用いて、DNA断裂末端にタンパク質が共有結合するように損傷を与えた場合と、DNA断裂末端がヘアピンループと呼ばれる高次構造を取る場合において、それぞれの断裂末端を修復できるかについて検討を行いました。その結果、ヘアピンループをもつ断裂末端は修復することができましたが、タンパク質が共有結合した末端は、一般的な修復過程で起きるMre11のエンドヌクレアーゼ活性に依存した「DNAの切れ目」は検出されるものの、それ以降の修復が全く進まないことを明らかにしました。また、Mre11のエンドヌクレアーゼ活性によってDNA上に導入された切れ目は、断裂末端から規則的に10塩基ごとに入っていることを発見しました。ここから、Mre11はDNA二重らせん構造の断裂末端の決まった位置を起点に、DNA分子の同一側面方向から等間隔で切れ目を入れるという、非常にユニークなエンドヌクレアーゼ活性を持つことが明らかになりました。
先行研究により、DNA断裂末端の修復の過程において、タンパク質などの付加物と一緒に切断されたDNAの長さは、付加物の大きさに比例することが知られています。今回用いた付加物はトポイソメラーゼタンパク質でとても大きいため、タンパク質から35塩基程度と近くに切れ目は入っても、DNAの二本鎖部分の水素結合が安定で、タンパク質はDNA末端から全く取り除かれていないことがわかりました。ここから、Mre11はまず、付加物に衝突することを刺激として付加物の大きさに応じてできるだけ近くにDNAに複数の切れ目を作り、付加物が大きい場合には、そこからMre11を3'-5'エキソヌクレアーゼ活性に切り替えることによって、付加物をDNA末端からはずすという機構が示唆されました。
抗がん剤の一種である「トポイソメラーゼ阻害剤」は、トポイソメラーゼIIを付加物として持つDNA断裂をがん細胞に導入することで、がん細胞に対して細胞毒性を発揮することがわかっています。今回、このようなDNA損傷にはMre11の3'-5'エキソヌクレアーゼ活性が必須であることが示され、抗がん剤に耐性を持つがん細胞が出現する機構の理解に役立つことが期待できます。また、Mre11の3'-5'エキソヌクレアーゼ活性は、付加物がついていないようなDNA断裂損傷の修復には必ずしも必要ではないことから、ヒトでも同様の機構がある場合、3'-5'エキソヌクレアーゼ活性を部分的に抑制することで、より少ない抗がん剤で効果を発揮するといった応用が可能になると考えられます。さらにヒトでは、Mre11やRad50の機能がDNA損傷修復の正確性を保証することで、体内でのがんの発生を強力に抑制していることが知られています。ここから、本研究成果は、ヒトの細胞ががん細胞へと変貌する仕組みの理解にも役立つと考えられます。
【研究者コメント】
篠原美紀(しのはらみき)
所属 :近畿大学農学部生物機能科学科
近畿大学大学院農学研究科
近畿大学アグリ技術革新研究所
職位 :教授
学位 :博士(医学)
コメント:今回の研究成果は、アメリカの研究グループが単離したものの、十分に行われていなかったRad50遺伝子変異株の解析を、共同研究で当研究室の卒業研究として私たちが得意とする解析方法をもちいて行ったことが発端になっています。変異酵母株の解析結果は、どれもMre11の3'-5'エキソヌクレアーゼ活性が特異的に欠損していると考えなければ説明がつかないものだと最初に気がついたのは、研究を行った当時4年生の学生です。私はすぐに日本語で作成された学生の卒業研究発表用のスライドを本人の了承を取って、そのままMre11の生化学的な酵素活性解析の第一人者であるスイスのPetr Cejka研究グループと、変異株を単離したアメリカの研究グループに送り、我々のアイデアを伝えて、変異型Rad50タンパク質の存在下でのMre11の酵素活性を精製したタンパク質を用いて、直接調べてほしいとお願いしました。先方はとても面白いということで、すぐに変異タンパク質を精製して酵素活性を解析してくれました。そして、私たちのモデルが正しいことが証明され、3カ国の共同研究が本格的に始動しました。学生は大学院に進学して、DNA損傷末端に付加物があるときの修復に、Mre11の3'-5'エキソヌクレアーゼ活性が必要と解明するまで研究を進めてくれました。長年の大学教員生活で学生と一緒に多くの研究を行ってきましたが、こんなにわくわくした研究テーマは久しぶりで、とても楽しい研究でした。
【用語解説】
※1 Mre11:ヒトではMre11-Rad50-Nbs1(酵母の場合はXrs2)の複合体として機能するタンパク質。DNAが断裂した際に、断裂末端上で修復に必要な細胞内でのDNA加水分解反応を司る鍵因子であり、がん抑制因子の一つ。
※2 ヌクレアーゼ:DNAやRNAなどの核酸を、加水分解する反応を触媒する酵素の総称。核酸のヌクレオチド間のリン酸ジエステル結合を切断することができる。
※3 エンドヌクレアーゼ:DNAのリン酸ジエステル結合を加水分解する活性の一つで末端のないDNA分子のリン酸骨格を切断することができる酵素活性。
※4 3'-5'エキソヌクレアーゼ:DNAの末端依存的に、DNA単鎖のリン酸ジエステル結合を加水分解することができる。DNAの両末端、つまり3'末端と5'末端のどちらから分解を開始するかによってさらに2種類に分かれ、3'-5'エキソヌクレアーゼ活性は3'末端からDNA分解を開始する酵素活性。
【関連リンク】
農学部 生物機能科学科 教授 篠原美紀(シノハラミキ)
https://www.kindai.ac.jp/meikan/2071-shinohara-miki.html